Sample preparation for electrophoresis
1. 개요
전기영동은 단백질 고유의 전하나 분자량의 차이를 이용하여 전기로 각 분자를 분리하는 방법입니다. 분자량이나 등전점 등 해석 목적에 따라서 SDS-PAGE나 Native-PAGE, 2차원 전기영동 등의 다양한 전기영동 방법이 활용되고 있습니다.
샘플의 준비 방법은 전기영동 방법에 따라 다릅니다. ATTO의 제품을 사용하여 전기영동 샘플을 준비하는 방법에 대해 알아보겠습니다.
2. 실험 과정
1. 샘플 제작, 단백질 추출
세포, 조직이나 미생물 등에서 RIPA Lysis buffer, Urea계열 추출액이나 SDS sample buffer를 이용하여 단백질을 추출합니다. Native PAGE나 2-D electrophoresis용 샘플 제작에는 SDS 등 극성이 있는 이온성 계면활성제는 사용하지 않습니다.
* 사용하는 제품 (Fractionation / Extraction Kit, Sample preparation solution)
AE-1430 EzApply, WSE-7010 EzLabel FluoroNeo, AE-1435 EzApply 2D Kit, WSE-7420 EzRIPA Lysis kit, etc.
2. 가열
SDS-PAGE용 샘플은 SDS와 환원제가 포함된 sample buffer와 혼합 후 95℃에서 3~10분간 가열처리합니다.
* 사용하는 제품 (Block incubator)
WSC-2615 MyMiniBLOCK C&H, etc.
3. 전기영동
SDS-Polyacrylamide gel electrophoresis로 단백질을 분리합니다. 목적하는 단백질에 따라 acrylamide의 농도를 바꿔줍니다. 목적하는 단백질의 분자량이 불분명한 경우, gradient gel을 사용합니다.
* 사용하는 제품 (Gel, running buffer)
e-PAGEL, AE-1410 EzRun, etc.
* 사용하는 제품 (전기영동장치, power supply)
WSE-1165 Mini-Slab, WSE-3400 myPower H300, etc.
4. Gel staining
전기영동 후의 gel은 CBB 등으로 염색하여 밴드를 확인하거나, Western blotting 등을 진행합니다.
* 사용하는 제품 (Gel staining)
AE-1340 EzStain AQua, AE-1310 EzStain Reverse, etc.
* 사용하는 제품 (Shaker)
WSC-2400 SeesawShaker atto
3. SDS-PAGE용 샘플 조제
3-1. SDS-PAGE용 샘플 조제 (AE-1430 EzApply)
SDS-PAGE는 대략적인 분자량 확인 및 정제도 분석에 사용되는 영동 방법입니다. 영동용 샘플은 SDS와 환원제가 첨가된 시약을 처리하므로 Protein complex는 해리되고, linearize된 후에 SDS가 부착(~1.4g of SDS/g of protein)되므로 단백질의 전하 및 구조와 상관없이 분자량 확인이 가능합니다.
(1) 실험재료
– 조직, 세포, 세균 등
– AE-1430 EzApply
– Microcentrifuge tube, tip, etc.
– Centrifuge, Pipette, etc.
(2) 실험방법
1. 50μL의 샘플에 50μL의 EzApply (2× concentration, DTT 첨가)를 넣어 섞어줍니다.
2. MyMiniBLOCK C&H로 95℃에서 5분간 가열합니다. (Boiling 가능)
3. 15,000 rpm에서 5분간 원심분리하여 상등액을 회수합니다. (원심분리하지 않아도 가능)
* 제작한 샘플은 -20℃에서 보존 가능합니다.
* 조직이나 세포 등을 직접 용해할 때는, EzApply를 증류수로 1× concentration 농도로 희석합니다. 조직 및 세포의 2.5~3배 용량의 1× EzApply를 첨가하여 해부용가위로 절단하거나 homogenizer 등을 통해 완전히 용해합니다. 용해 후의 추출액은 위에서 설명한 방법과 마찬가지로 가열하여 원심 후의 상등액을 다른 튜브에 회수합니다.
3-2. 형광표지용 샘플 조제 (WSE-7010 EzLabel FluoroNeo)
WSE-7010 EzLabel FluoroNeo는 SDS sample buffer 대신 단백질 용액과 혼합하여 가열하는 것만으로 단백질의 형광표지와 동시에 전기영동용 샘플 조제가 가능합니다. 전기영동 후의 gel은 즉시 Blue LED 또는 UV로 excitation하여 밴드 검출이 가능합니다. (Excitation 330nm (UV), 470nm(Blue LED), Emission 530 nm)
(1) 실험재료
– 조직, 세포, 세균 등
– WSE-7010 EzLabel FluoroNeo
– Microcentrifuge tube, tip, etc.
– WSE-5510-5520 VariRays, Centrifuge, Pipette, etc.
(2) 실험방법
1. 40μL의 단백질 샘플에 WSE-7010 EzLabel FluoroNeo에 포함된 10μL의 Sample buffer (5× conc.)와 Labeling reagent 0.5μL를 첨가하여 혼합합니다.
2. MyMiniBLOCK으로 95℃에서 3분간 가열합니다. (Boiling 가능)
3. 2.의 혼합액에 Readucing agent (DTT)를 2μL 첨가하여 혼합합니다.
4. MyMiniBLOCK으로 95℃에서 3분간 가열합니다. (Boiling 가능)
* 제작한 샘플은 -20℃에서 차광 보존이 가능합니다.
* 샘플의 용매에 Tris 등의 아미노기가 포함되면 비특이적인 signal이 검출될 수 있습니다. 이 경우, 전기영동 후의 gel을 증류수로 세척하면 비특이적 signal은 소실됩니다.
* 샘플 중에 환원제가 포함되면 형광 표지 반응을 현저하게 방해하는 원인이 됩니다. 형광 표지 후에 환원 처리를 해주십시오.
* 형광 표지 단백질은 Western blotting에 사용이 가능합니다. 형광 signal을 이용하여 transfer 효율 등을 확인할 수 있습니다.
3-3. 참고 데이터 (WSE-7010 EzLabel FluoroNeo)
실험예1: EzLabel FluoroNeo로 제조한 샘플
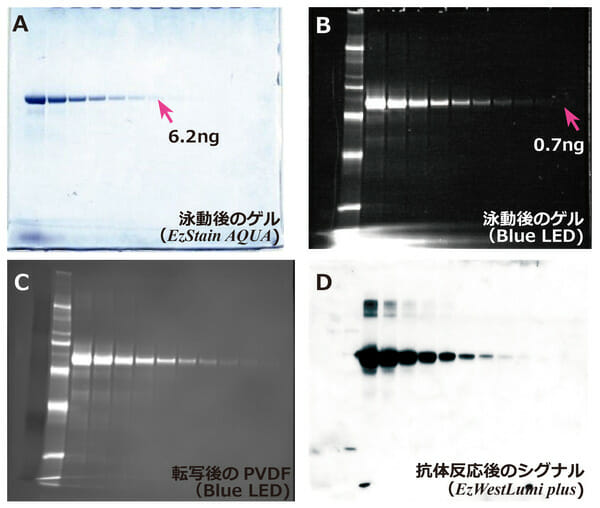
(A) Human transferrin protein을 AE-1430 EzApply로 처리하여 400 ng/lane을 1/2 dilution factor로 전기영동하고 AE-1340 EzStain AQua로 staining한 결과입니다.
(B)~(D)는 (A)와 동일한 조건에서 Human transferrin protein을 WSE-7010 EzLabel FluoroNeo로 처리한 전기영동샘플을 사용하였습니다.
(B) 형광표지 후 전기영동한 gel을 Varirays (Blue)로 540LP filter를 사용하여 촬영한 결과입니다.
(C) B에서 촬영한 gel을 AE-1465 EzFasBlot으로 가볍게 세척하고, AE-1465 EzFasBlot을 사용하여 P plus (PVDF) membrane에 transfer하였습니다. 이를 B의 조건과 동일하게 Varirays (Blue)로 540LP filter를 사용하여 촬영하였습니다.
(D) C의 membrane을 AE-1475 EzBlock Chemi로 blocking한 후, anti-human transferrin antibody 및 HRP-labeled 2nd antibody와 반응하여 WSE-7120 EzWestLumi plus로 검출하였습니다.
WSE-7010 EzLabel FluoroNeo로 형광표지한 단백질은 CBB staining한 gel보다 검출감도가 높고, 전기영동 후 즉시 단백질 검출이 가능합니다. Transfer 후 membrane상의 단백질도 Blue LED로 쉽게 확인이 가능하여 transfer 효율 등을 확인할 수 있습니다. 또한 Western blotting의 항체 반응을 방해하지 않고 검출이 가능합니다.
4. 등전점 전기영동용 샘플 조제
4-1. 등전점전기영동용 샘플의 조제 (AE-1435 EzApply 2D Kit)
2차원 전기영동은 1차원 전기영동에서 등전점 전기영동을, 2차원 전기영동에서 SDS-PAGE를 실시하여 단백질을 분리합니다. 등전점 전기영동은 단백질 고유의 전하 (등전점, pI)를 이용하여 분리하는 방법입니다. 전기영동 샘플은 고농도의 Urea로 추출하고 -SH 환원처리를 하기 때문에 단백질의 입체구조는 무시할 수 있다고 알려져 있습니다.
(1) 실험재료
– 조직, 세포, 세균 등
– AE-1435 EzApply 2D Kit
– Microcentrifuge tube, tip, etc.
– Ultrasonicator
– WSE-5510/5520 VariRays, Centrifuge, Pipette, etc.
(2) 실험방법
1. 조직은 생리식염수 등으로 세척 후 해부용 가위로 세단합니다. 세단 후 조직 및 세포, 세균을 Kit에 첨부된 1 mL의 Wash buffer로 세척합니다.
2. 원심분리 (4,000 rpm, 10~60 sec)하여 상등액을 폐기합니다.
3. Pellet의 2.5~3배 용량의 Solution 2를 첨가하여 초음파 파쇄합니다.
* DNA가 추출되어 용매의 점성이 높아지지만, 초음파 파쇄에 의해 경감됩니다.
* 가용성 성분과 불용성 성분을 나누어 추출하는 경우는, Solution 1을 사용하여 2단계로 추출합니다. 자세한 내용은 Kit에 첨부된 설명서를 확인해주십시오.
4. 13,000~17,000×g에서 10~20분간 원심분리합니다.
5. 상등액을 회수하고 1/5 용량의 Solution 2-2를 첨가하여 상온에서 10분간 반응합니다. (환원 알킬화 처리)
* 환원 알킬화 처리는 필수는 아닙니다.
4-2. 참고 데이터 (AE-1435 EzApply 2D Kit)
실험예2: 2차원 전기영동 결과
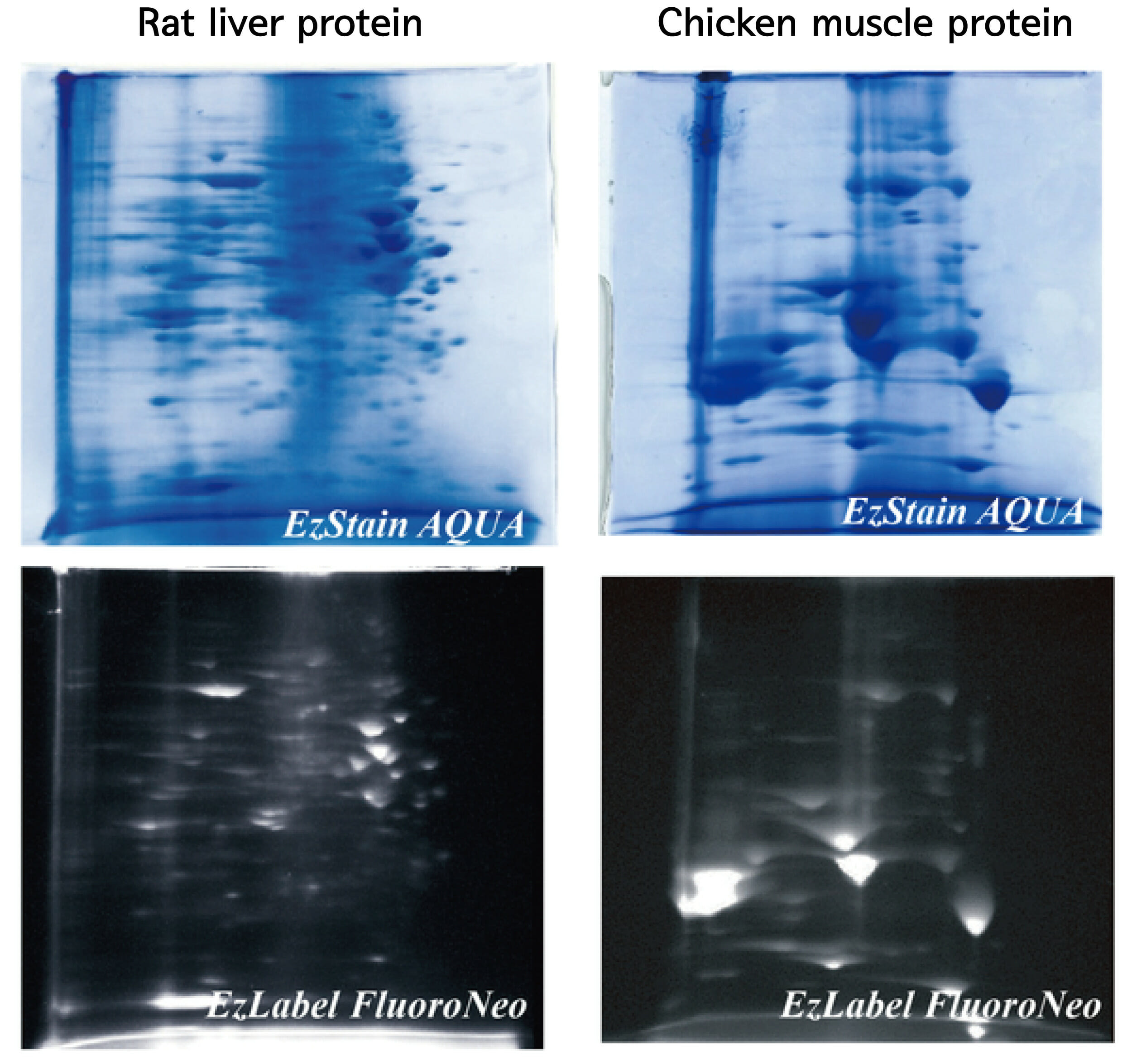
Rat의 liver와 Chicken의 muscle에서 AE-1435 EzApply 2D Kit를 사용하여 단백질을 추출하고, agarGEL (A-M310)을 사용하여 1차원 등전점 전기영동을 실시하였습니다. 위쪽의 사진은 1D gel을 일반적인 방법으로 SDS equilibrium 처리하고, 아래쪽은 SDS equilibrium 처리 시 WSE-7010 EzLabel FluoroNeo의 1× sample buffer (Labeling reagent 첨가, DTT 비첨가) 처리하여 30분간, 1× sample buffer (DTT 첨가)로 30분간 처리하였습니다. 2차원 전기영동은 e-PAGEL (E-D520L)을 사용하여 분리하였습니다. 상단은 전기영동 후 gel을 AE-1340 EzStain AQua로 염색한 결과입니다. 하단은 전기영동 후 gel을 VariRays(Blue)로 excitation하고 540LP filter를 사용하여 촬영한 결과입니다. 1차원 분리에 agarGEL을 사용하여 다량의 단백질을 apply하여 분리할 수 있고, 고분자 단백질도 해석이 가능합니다.
5. 참고
Native-PAGE용 샘플의 조제
Native-PAGE는 단백질을 변성시키지 않고 전기영동으로 분리하는 방법입니다. 단백질의 complex, 입체구조, 분자량, 전하가 모두 영향을 미치므로 sharp한 밴드패턴을 얻기가 어렵습니다. 그래서 샘플을 Urea 처리 등으로 linearize하거나 Blue-Native PAGE와 같이 sample buffer와 running buffer에 약간의 전하를 부가하여 전기영동 하는 방법도 있습니다. 분리하는 목적단백질의 전하(pI)에 맞추어 Tris-Glycine (pH 8.3~9.5), Tris-borate (pH 7.0~8.5), Tris-acetate (pH 7.2~8.5) 등의 running buffer를 음극과 양극측에서 조합하여 단백질을 분리합니다.
제조 방법
1. 40 μL의 샘플에 10 μL Native sample buffer (5×)를 첨가하여 혼합합니다.
2. 샘플은 가열처리하지 않습니다. Target protein의 등전점에 맞추어 Running buffer를 음극과 양극으로 조합하여 사용합니다. 또한 전기영동은 저온에서 천천히 진행합니다.
주요 전기영동 sample buffer의 조성
전기영동 sample 조정에 사용하는 주요 sample buffer의 조성입니다. 보다 재현성이 높고 간편한 실험을 위해서는 PAGEL 등 precast gel이나 ATTO의 시약을 이용하십시오.
SDS sample buffer (5×): 250 mM Tris-HCl (pH 6.8), 8% SDS, 0.1% Bromophenol blue, 40% Glycerol, 100 mM DTT
Native sample buffer (5×): 250 mM Tris-HCl (pH 6.8), 0.1% Bromophenol blue, 40% Glycerol
등전점전기영동 단백질 추출액 (O’Farrell method): 9.5 M Urea, 2% Np-40, 1.6% Ampholine 5-7, 0.4% Ampholine 3-10, 5% β-Mercaptoethanol / 10 mL
Related Products
WSE-6370 Luminograph III Lite
고해상도 6MP CCD카메라와 초고감도 F0.8렌즈 탑재
PC control type Chemiluminescence imaging system
Tips for Electrophoresis
- Basic operation of SDS-PAGE (Polyacrylamide Gel Electrophoresis)
- Method for extracting protein from tissue or cell
- Sample preparation for electrophoresis
- Preparation of polyacrylamide gel
- Polyacrylamide gel electrophoresis (PAGE)
- Principles and method of the 2-dimensional electrophoresis
- Protein electrophoresis gel staining
- Agarose gel electrophoresis (horizontal electrophoresis)
- How to choose the power supply





