Basic operation of SDS-PAGE (Polyacrylamide Gel Electrophoresis)
1. 개요
전기영동은 단백질 고유의 전하나 분자량의 차이를 이용하여 전기로 각 분자를 분리하는 방법입니다. 가장 많이 사용되는 SDS-PAGE는 단백질에 SDS를 부가하여 음극으로 대전시키고 acrylamide gel의 mesh구조를 이용하여 단백질 분자량의 차이로 분리합니다. ATTO의 제품을 사용하여 SDS-PAGE의 기본 조작에 대해 소개하겠습니다.
2. 실험 과정
1. 샘플 제작
세포, 조직이나 미생물 등에서 RIPA Lysis buffer, Urea계열 추출액이나 SDS sample buffer를 이용하여 단백질을 추출합니다.
* 사용하는 제품 (Fractionation / Extraction Kit, Sample preparation solution)
AE-1430 EzApply, WSE-7010 EzLabel FluoroNeo, WSE-7420 EzRIPA Lysis kit, etc.
* 사용하는 제품 (Block incubator)
WSC-2615 MyMiniBLOCK C&H, etc.
2. Gel 제작
목적하는 단백질의 분리에 적합한 acrylamide 농도의 gel을 제작합니다. Precast gel을 사용하면 보다 빠르게, 정밀하고 재현성이 높은 실험을 할 수 있습니다.
* 사용하는 제품 (Gel buffer)
WSE-7310 EzGel Ace, WSE-7155 EzGel Stack, WSE-7150 EzGel Sep
Gel Caster
3. 전기영동
SDS-Polyacrylamide gel electrophoresis로 단백질을 분리합니다. 목적하는 단백질에 따라 acrylamide의 농도를 바꿔줍니다. 목적하는 단백질의 분자량이 불분명한 경우, gradient gel을 사용합니다.
* 사용하는 제품 (Gel, running buffer)
e-PAGEL, AE-1410 EzRun, etc.
* 사용하는 제품 (전기영동장치, power supply)
WSE-1165 Mini-Slab, WSE-3400 myPower H300, etc.
4. Gel staining
전기영동 후의 gel은 CBB 등으로 염색하여 밴드를 확인하거나, Western blotting 등을 진행합니다.
* 사용하는 제품 (Gel staining)
AE-1340 EzStain AQua, AE-1310 EzStain Reverse, etc.
* 사용하는 제품 (Shaker)
WSC-2400 SeesawShaker atto
3. 기기 · 시약 · 재료
- 세포, 조직 샘플 등 (ex. Hela cell)
- 단백질 추출, 처리시약 – AE-1430 EzApply, WSE-7010 EzLabel FluoroNeo
- Precast gel – e-PAGEL
- Running buffer – AE-1410 EzRun, WSE-7065 EzRun MOPS
- Block incubator – WSC-2615 MyMiniBLOCK C&H
- 전기영동장치 – WSE-1165 Mini-Slab, WSE-1150 PageRunAce
- Power supply – WSE-3400 myPower H300
- Staining solution – AE-1340 EzStain AQua, AE-1310 EzStain Reverse
- Tray (Gel보다 약간 큰 것)
- Shaker – WSC-2400 SeesawShaker atto
< Gel을 제작하는 경우 >
- Gel buffer – WSE-7310 EzGel Ace, WSE-7150 EzGel Sep, WSE-7155 EzGel Stack, etc.
- Acrylamide monomer – Acrylamide/bis solution
- Polymerization initiator – Ammonium persulfate (APS)
- Polymerization accelerator – N,N,N’,N’,-Tetramethylethylenediamine (TEMED)
- Distilled water
- Gel caster / Multiple gel caster
- Gel plate
- Comb
- Spacer
4. 실험 방법
4-1. 샘플의 조제
< 통상적인 전기영동 샘플 >
1. 50μL의 샘플에 50μL의 AE-1430 EzApply (2× concentration, DTT 첨가)를 넣어 섞어줍니다.
2. MyMiniBLOCK C&H로 95℃에서 5분간 가열합니다. (Boiling 가능)
3. 15,000 rpm에서 5분간 원심분리하여 상등액을 회수합니다. (원심분리하지 않아도 가능)
* 제작한 샘플은 -20℃에서 보존 가능합니다.
* AE-1430 EzApply 대신에 5× SDS gel loading buffer를 사용할 수도 있습니다.
< 형광 라벨 전기영동 샘플 >
1. 40μL의 단백질 샘플에 WSE-7010 EzLabel FluoroNeo에 포함된 10μL의 Sample buffer (5× conc.)와 Labeling reagent 0.5μL를 첨가하여 혼합합니다.
2. MyMiniBLOCK으로 95℃에서 3분간 가열합니다. (Boiling 가능)
3. 2.의 혼합액에 Readucing agent (DTT)를 2μL 첨가하여 혼합합니다.
4. MyMiniBLOCK으로 95℃에서 3분간 가열합니다. (Boiling 가능)
* 제작한 샘플은 -20℃에서 차광 보존이 가능합니다.
참고: 자세한 내용은 “Method for extracting protein from tissue or cell“, “Sample preparation for electrophoresis“를 참조하십시오.
4-2. Gel의 제작
- Gel을 직접 제작할 때에는 아래 A~D의 용액이 필요합니다.
(A) Acrylamide/bis solution
Acrylamide/bis solution은 분획분자량 범위에 따라서 일반적으로 19:1, 29:1, 37.5:1 용액이 사용됩니다. Crosslinker 비율이 높을수록 저분자량의, crosslinker 비율이 낮을수록 고분자 단백질의 분획범위가 넓어집니다. 목적하는 분획 범위에 따라 아래의 예를 참고로 선택하여 준비하십시오.
< 30(w/v)% acrylamide/bis(29:1) solution >
29 g의 acrylamide와 1 g의 N,N’-methylene-bis (acrylamide)를 칭량하여 50 mL의 증류수에 용해합니다. 용해 후 증류수를 첨가하여 100 mL로 맞춰줍니다.
* Acrylamid monomer에는 신경독성이 있습니다. 취급할 때에는 장갑 등을 착용하여 신체를 보호하십시오.
* Acrylamide/bis solution은 30(w/v)% Acrylamide/bis (29:1) solution이나 30(w/v)% Acrylamide/bis (37.5:1) solution 등이 시판되고 있습니다. Crosslinker 비율이 높다면 (N,N’-methylene-bis (acrylamide) 비율이 높음) crosslink 구조가 늘어나 격자 구조가 촘촘한 gel이 제작되어 저분자 단백질 영역의 분획이 명료해집니다.(B) Gel buffer
– WSE-7310 EzGel Ace
중성의 gel buffer로 stacking gel 및 separating gel에 사용이 가능합니다. 제작한 gel은 장기 냉장보관이 가능합니다. (약 1개월)
– WSE-7155 EzGel Stack
Laemmli method에 따른 stacking gel buffer입니다. 0.5 M Tris-HCl (pH 6.8)에 대응되는 buffer입니다.
– WSE-7150 EzGel Sep
Laemmli method에 따른 separating gel buffer입니다. 1.5 M Tris-HCl (pH 8.8)에 대응되는 buffer입니다.
* Gel buffer는 WSE-7310 EzGel Ace 단독으로 사용하거나, WSE-7155 EzGel Stack, WSE-7150 EzGel Sep의 조합으로 사용해주십시오.(C) 10% APS (Ammonium persulfate)
0.1 g의 APS를 칭량하여 1 mL의 증류수에 용해합니다.
* 10% APS는 서서히 활성이 떨어지므로 필요시 제작하는 것을 권장합니다. 냉장고에 일주일 정도 보관 가능합니다.(D) TEMED (N,N,N′,N′-Tetramethylethylenediamine)
원액을 그대로 사용합니다.참고: 더 자세한 내용은 “Preparation of polyacrylamide gel“도 참조하십시오.
주요 전기영동용 시약의 조성
전기영동에 사용하는 주요 시약의 조성입니다. 보다 재현성이 높고 간편하게 실험할 때에는 e-PAGEL 등 precast gel이나 ATTO 시약을 사용하세요.Sample buffer (5×)
250 mM Tris-HCl (pH 6.8), 8% SDS, 0.1% Bromophenol blue, 40% Glycerol, 100 mM DTT
Stacking gel buffer
0.5 M Tris-HCl (pH 6.8)
Separating gel buffer
1.5 M Tris-HCl (pH 8.8)
Acrylamide stock solution
30% Acrylamide/N,N’-methylene-bis acrylamide (29:1)
Running buffer
25 mM Tris, 192 mM Glycine, 0.1% SDS
CBB staining solution
0.25% Coomassie Brilliant Blue, 40% Methanol, 7% Acetic acid
Destaining solution
40% Methanol, 7% Acetic acid
2. Gel 용액을 제작합니다.
Gel 조성표 (아래 표)에 따라 Separating gel과 Stacking gel의 gel 용액을 제작합니다.
* APS와 TEMED 이외의 용액을 혼합합니다.
| Separating gel | Stacking gel | ||||
|---|---|---|---|---|---|
| Gel concentration | 7.5% | 10% | 12.5% | 15% | 4.5% |
| DW | 5 mL | 4.2 mL | 3.3 mL | 2.5 mL | 3 mL |
| Acrylamide/bis solution | 2.5 mL | 3.3 mL | 4.2 mL | 5 mL | 0.75 mL |
| Gel buffer | 2.5 mL | 2.5 mL | 2.5 mL | 2.5 mL | 1.25 mL |
| 10% APS | 0.075 mL | 0.05 mL | 0.05 L | 0.05 mL | 0.05 mL |
| TEMED | 0.005 mL | 0.005 mL | 0.005 mL | 0.005 mL | 0.003 mL |
* 위 표는 Mini-gel size 1장에 필요한 용량입니다.
3. Separating gel 용액에 APS와 TEMED를 첨가하여 거품이 나지 않도록 혼합한 후 gel plate에 separating gel 용액을 흘려 넣습니다.
* 전기영동장치 및 gel caster의 사용방법은 각 제조사에 문의해주십시오.
4. 경계면이 흐트러지지 않도록 주의하면서 증류수를 중층합니다. (0.2~1.0 mL)
* Acrylamide는 산소가 있으면 중합이 잘 안되므로 증류수를 중층하여 공기 중의 산소를 차단합니다.
5. 실온에서 30분 이상 정치하여 중합합니다.
* Gel의 경계면이 명확하게 보이는 것을 확인합니다. 중합 시간은 계절이나 실온에 따라 달라집니다. 20℃ 이하에서는 중합하기 어려워지므로 주의해주십시오.
6. 중층된 증류수를 filter paper 등으로 흡수하여 완전히 제거합니다.
7. Stacking gel 용액에 APS와 TEMED를 첨가하여 거품이 나지 않도록 혼합한 후 separating gel 위에 stacking gel 용액을 중층합니다.
8. Comb을 꽂고 실온에서 30분 이상 정치하여 중합합니다.
* WSE-7310 EzGel Ace를 사용하여 제작한 gel은 랩 등으로 감싸고, 지퍼백 등에 넣어 1× EzGel Ace 용액을 첨가하여 (약 5 mL/gel) 냉장에서 1개월간 보관이 가능합니다. Laemmli method의 gel buffer로 제작한 gel은 보존이 어려우므로 당일에 사용해주십시오.
4-3. 전기영동
1. 전기영동장치 하부조에 충분한 양의 running buffer를 넣습니다.
* Running buffer가 부족하면 전기영동 패턴이 흐트러지는 원인이 됩니다.
2. 제작한 gel 또는 precast gel (e-PAGEL 등)을 gel 하단에 공기가 들어가지 않도록 주의하여 전기영동장치에 세팅합니다.
3. 상부조에 충분한 양의 running buffer를 넣습니다.
4. Well에 샘플을 loading합니다. (5~10 μL/lane)
* 샘플의 농도는 정제단백질의 경우 100 ng~1 μg/lane, 추출액의 경우 1~50 μg/lane이 적당합니다.
5. 시작 버튼을 눌러 전기영동을 시작합니다.
*20 mA/gel로 약 80분간 또는, 40 mA/gel로 약 35분간 전기영동합니다.
4-4. Gel staining
1. AE-1340 EzStain AQua를 gel보다 약간 큰 tray에 넣습니다. (30~50 mL/gel)
2. 전기영동 직후의 gel을 EzStain AQua에 담그고 실온에서 3시간~overnight 동안 shaking하면서 staining합니다.
* 고농도의 단백질 염색에는 장시간이 필요합니다.
* 전자레인지를 사용하면 빠르게 염색할 수 있습니다.
3. 단백질 밴드가 충분히 staining되었음을 확인한 후 EzStain AQua를 폐기하고 증류수로 gel을 가볍게 헹굽니다. 충분한 양의 증류수를 가하여 탈색합니다. 중간중간 증류수를 새로 교체하고, background가 투명해질 때까지 탈색합니다.
* 용액 폐기시에는 색소폐액으로 적절한 처리를 해주십시오.
* 전자레인지를 사용하면 빠르게 탈색이 가능합니다.
* 직접 제조한 CBB staining solution을 사용할 경우, staining은 6시간 이상, destaining solution 처리는 4~6시간 이상 수행해주십시오. 또한 직접 제조한 CBB staining solution은 AE-1340 EzStain AQua보다 검출 감도가 낮기 때문에 샘플 loading양에 주의해주십시오.
5. 참고 결과
실험예1. Staining 방법의 차이
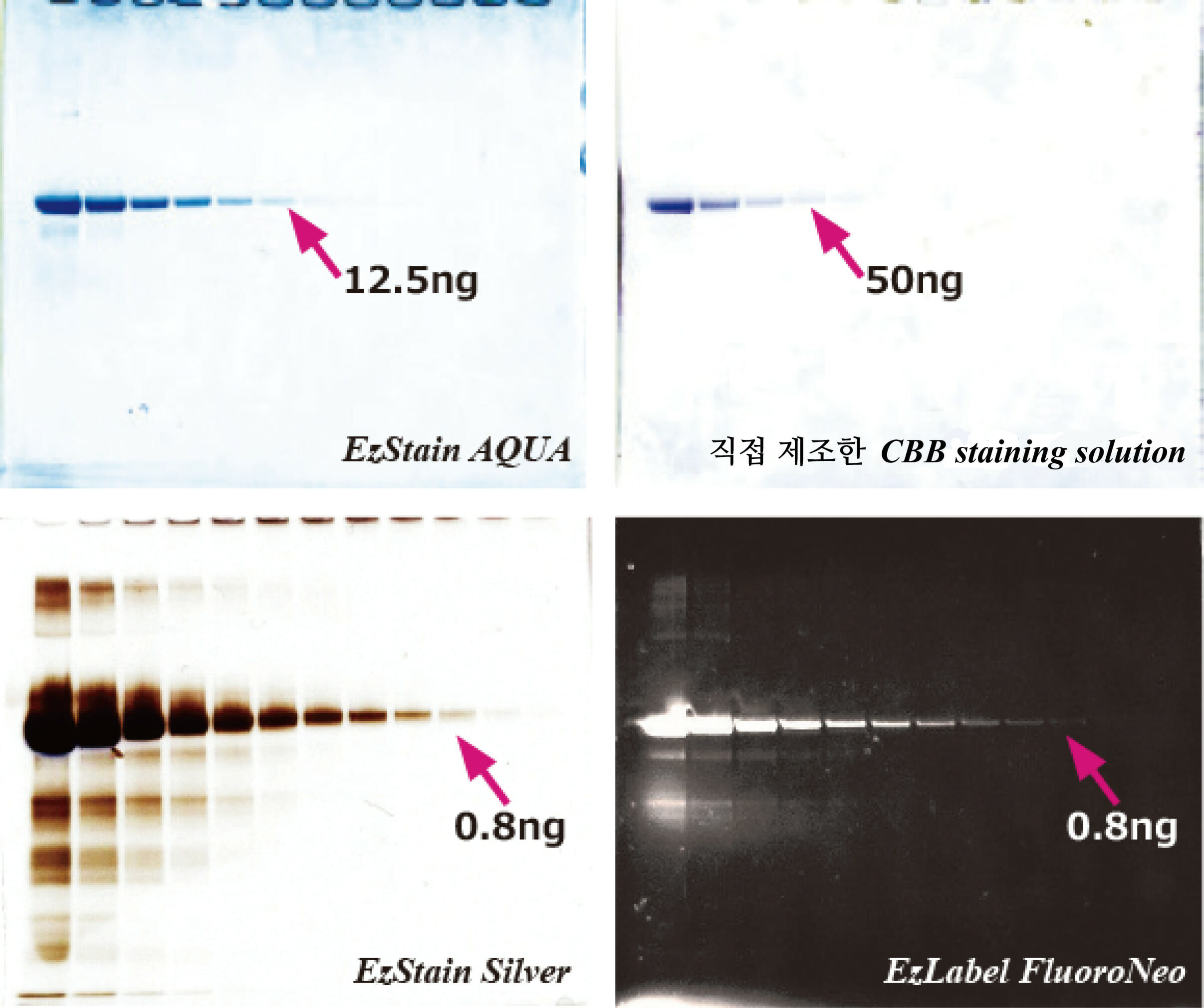
위의 사진은 Transferrin protein을 AE-1430 EzApply 또는 WSE-7010 EzLabel FluoroNeo를 사용하여 전기영동 샘플을 제작한 후에 c-PAGEL을 사용하여 400 ng부터 1/2 dilution factor로 loading하여 전기영동한 결과입니다. 전기영동 후 gel은 EzStain AQua, 직접 제조한 CBB staining solution 및 EzStain Silver로 staining하였습니다. EzLabel FluoroNeo 샘플은 전기영동 후 gel을 CyanoView로 excitation하고 540 nm LP filter를 이용하여 0.5초간 exposure하여 LuminoGraph로 촬영한 결과입니다. 직접 제작한 CBB staining solution보다 EzStain AQua는 검출 감도가 높으며, EzLabel FluoroNeo는 silver staining과 동등 이상의 검출 감도를 보였습니다. EzLabel FluoroNeo는 staining에 소요되는 시간이 필요없으며, 촬영 후 gel은 western blotting 등의 실험에도 사용할 수 있어 단시간에 효율적인 실험이 가능합니다. 한편, staining한 후의 gel은 western blotting 실험에 적합하지 않습니다. Staining 방법은 실험 목적이나 검출 감도에 맞게 선택하여 주십시오.
실험예2. Running buffer의 차이
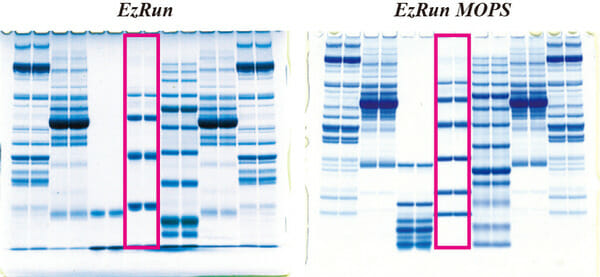
위 사진은 다양한 단백질을 동일한 acylamide 농도의 10% e-PAGEL HR을 이용하여 running buffer가 다른 조건, AE-1410 EzRun (왼쪽)과 WSE-7065 EzRun MOPS (오른쪽)에서 전기영동한 결과입니다. 빨간색 사각형 부분은 양쪽 모두 molecular weight marker인 AE-1440 EzStandard를 전기영동한 lane입니다. EzRun에서는 4개의 밴드가 검출된 반면, EzRun MOPS에서는 6개의 밴드가 검출되고 있어서 저분자 단백질도 분리가 용이합니다. 즉, running buffer를 EzRun MOPS로 변경하는 것만으로 10% 농도의 gel이 gradient gel과 유사한 밴드 패턴을 보이게 됩니다. 이처럼 running buffer를 교체함으로 동일한 acrylamide 농도의 gel을 사용하더라도 단백질의 분리 범위를 바꿀 수 있습니다.
Related Products
WSE-6370 Luminograph III Lite
고해상도 6MP CCD카메라와 초고감도 F0.8렌즈 탑재
PC control type Chemiluminescence imaging system
Tips for Electrophoresis
- Basic operation of SDS-PAGE (Polyacrylamide Gel Electrophoresis)
- Method for extracting protein from tissue or cell
- Sample preparation for electrophoresis
- Preparation of polyacrylamide gel
- Polyacrylamide gel electrophoresis (PAGE)
- Principles and method of the 2-dimensional electrophoresis
- Protein electrophoresis gel staining
- Agarose gel electrophoresis (horizontal electrophoresis)
- How to choose the power supply




