Agarose gel electrophoresis (horizontal electrophoresis)
1. 개요
Agarose gel을 사용한 전기영동은 핵산을 분석하는 수단으로 널리 쓰이는 방법입니다. Gel을 완충액에 가라앉혀 전기영동을 하기 때문에 잠수함 (Submarine)에 비유하여, 이 방법은 Submarine electrophoresis라고도 불립니다.
DNA를 구성하고 있는 nucleotide는 인산 잔기에 의해 (-) 전하를 띱니다. Agarose gel에 DNA 샘플을 loading하고 buffer 안에서 전기를 흘려 보내면 DNA는 (+) 극으로 이동합니다. 이 때 agarose gel의 그물 구조에 의해 큰 사이즈의 DNA는 천천히 이동하는 반면, 작은 DNA는 더 빠르게 이동합니다. 이 원리를 이용하여 DNA를 분리하는 방법이 agarose gel electrophoresis입니다.
단백질 전기영동에 자주 사용되는 polyacrylamide gel도 같은 망 구조를 가지는데, agarose gel의 망 구조는 망이 더 커서 DNA분리에 사용됩니다. Agarose gel은 약 0.5~20 kbp의 DNA를 분리하는데 적합하다고 알려져 있습니다.
ATTO의 제품을 사용한 submarine 방식의 agarose gel electrophoresis의 기본 조작에 관해서 소개합니다.
2. 실험 과정
Agarose gel electrophoresis의 실험 흐름을 소개합니다.
샘플 조제
세포자 조직, 혈액 등 시료로부터 DNA를 추출합니다. 추출한 DNA를 EzApply DNA와 혼합하고 전기영동 샘플을 제작합니다.
* 사용하는 제품 (Loading buffer)
WSE-7040 EzApply DNA
Gel 제작
목적하는 DNA 분리에 적합한 농도의 agarose gel을 제작합니다.
WSE-7050 EzRun TAE 또는 WSE-7051 EzRun TBE buffer에 정량한 agarose를 넣고 전자레인지 또는 중탕으로 agarose를 용해합니다.
* 사용하는 제품 (Gel buffer)
WSE-7050 EzRun TAE, WSE-7051 EzRun TBE
전기영동
WSE-1710 Submerge-Mini (전기영동장치)로 전기영동을 수행하여 DNA를 분리합니다.
* 사용하는 제품 (전기영동장치)
WSE-1710 Submerge-Mini
* 사용하는 제품 (Gel buffer)
WSE-7050 EzRun TAE, WSE-7051 EzRun TBE
Gel staining, 촬영
전기영동 후의 gel을 WSE-7130 EzFluoroStain DNA 또는 EtBr (Ethidium bromide)로 staining합니다.
염색 후 gel을 형광촬영하여 분리된 밴드를 확인, 분석합니다.
* 사용하는 제품 (Gel staining solution)
WSE-7130 EzFluoroStain DNA
3. 실험하기 전에
DNA, RNA를 절단하는 효소인 DNase (Deoxyribonuclease)나 RNase (Ribonuclease)는 자연계의 모든 곳에 존재합니다. 실험에 사용하는 시약이나 기구가 nuclease가 오염되면 샘플인 DNA와 RNA가 분해되어 실험의 실패로 이어집니다. DNA나 RNA를 이용하는 실험을 실시할 때에는 DNase나 RNase를 주의해야 합니다.
DNA 취급 시의 주의 사항
DNA를 분해하는 효소인 DNase는 평상시 우리 손에 충분히 존재합니다. DNA를 이용한 실험을 할 때에는 반드시 latex glove를 착용하고 ethanol을 적절히 사용합니다.
DNase는 autoclave 멸균처리로 불활성화가 가능합니다. 따라서 실험에 사용하는 tip이나 tube 등의 플라스틱 제품, 샘플 조제나 전기영동에 사용하는 buffer류나 증류수는 반드시 autoclave 처리를 한 후 실험에 사용합니다. 단, 전기영동 후에 DNA band를 회수하지 않는 경우, gel이나 gel buffer의 멸균은 불필요합니다.
RNA 취급 시의 주의 사항
RNA는 매우 민감한 핵산으로 RNase에 의해 빠르게 분해되기 때문에 RNA를 사용하는 실험은 RNase-free 조건하에서 하는 것이 절대적입니다. RNA를 분해하는 효소인 RNase는, 실활하기 어려운데다가 autoclave나 자외선 (UV) 조사, ethanol에 대해서도 매우 높은 내성이 있다고 합니다. 실험할 때에 손에 latex glove를 착용하는 것은 물론, 그외에도 증류수나 버퍼를 DEPC 처리해야 합니다.
DEPC란?
Diethylpyrocarbonate (DEPC)는 RNase를 실활시키기 위한 시약입니다. DEPC는 매우 강력한 RNase 저해 효과를 가지고 있으며, RNA를 취급할 때 RNA가 분해되지 않도록 하기 위해 자주 이용되고 있습니다. 그러나 위험물로 지정되어 있는 시약으로 발암성, 인화성이 있으므로 취급에 주의를 기울이고 작업은 latex glove를 반드시 착용하여 후드 내에서 진행합니다.
DEPC water 제작 방법
1. 밀폐가능한 용기에 멸균된 distilled water 1000 mL을 넣고 DEPC 1 mL을 첨가한다. (Final concentration 0.1%가 되도록 DEPC를 첨가합니다)
2. 용기를 잘 흔들어 DEPC를 용해한다.
3. 37℃에서 2시간 이상 둔다. (실온에서 overnight도 가능합니다)
4. 용기 뚜껑을 살짝 열고 autoclave (121℃, 20min)하여 DEPC를 불활성화한다.
5. Autoclave 후에 실온에서 보관한다.
RNA 실험에 사용하는 증류수나 buffer 등에는 반드시 DEPC water를 사용합니다. 전기영동에 사용하는 gel을 제작하기 위한 buffer도 반드시 DEPC water로 조제한 것을 사용합니다.
플라스틱 제품이나 전기영동조도 RNase free 처리가 필요합니다. 기구는 깨끗이 세척하고 95% ethanol로 가볍게 헹구어줍니다. 3% 과산화수소수 (distilled water로 제작한 것)에 담가 실온에 15분 정도 놓아둡니다. 그 후 DEPC water로 3회 정도 헹구어 건조하면 기구의 RNase free 처리가 가능합니다.
4. 실험 방법
ATTO 제품을 사용하여 agarose gel electrophoresis 실험 방법을 소개합니다.
4-1. 샘플 제작
1. 세포나 조직 등의 시료에서 DNA extraction kit를 이용하여 DNA를 추출합니다.
2. EzApply DNA (6× concentration) 1 μL에 추출한 샘플 5 μL를 첨가하여 혼합합니다.
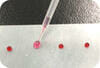
[Parafilm을 사용하여 시료를 조제하는 경우]
Parafilm 위에 EzApply DNA를 1 μL 떨어뜨리고 여기에 추출한 샘플 5 μL를 더해 pipetting으로 혼합합니다. (아래 사진 참조)
4-2. Gel의 제작
WSE-1710 Submerge-Mini는 gel tray(L) 1장당 25~40 mL, gel tray(S) 1장당 15~20 mL의 agarose gel buffer가 필요합니다.
Agarose gel buffer 양은 gel의 두께에 따라 다르며 최적의 gel 두께는 4~6 mm입니다. Gel이 두꺼우면 밴드가 흐릿하게 보이거나 background가 높아지는 원인이 되기도 합니다.
1. 분리하는 DNA의 크기에 따라 목적하는 농도의 agarose gel buffer가 되도록 agarose를 정량합니다. (아래 표 참조)
Agarose gel buffer volume (mL) × Gel concentration (%) = Agarose amount (g)
예) 1.0%의 L size agarose gel을 제작할 경우
40 mL (gel buffer volume) × 1.0% (gel concentration) = 0.4 g
0.4 g의 agarose를 40 mL의 gel buffer에 용해한다.
| Agarose gel concentration (w/v) | DNA separation range (bp) |
|---|---|
| 0.6% | 1,000 ~ 20,000 |
| 0.7% | 800 ~ 10,000 |
| 1.0% | 500 ~ 7,000 |
| 1.2% | 400 ~ 6,000 |
| 1.5% | 200 ~ 3,000 |
| 2.0% | 100 ~ 2,000 |
2. 1.에 gel buffer (1× WSE-7050 EzRun TAE 또는 1× WSE-7051 EzRun TBE)를 필요량 첨가합니다.
3. 전자레인지 또는 중탕으로 가열하여 agarose를 완전히 용해합니다.
* 용해 후 agarose gel buffer는 끓을 가능성이 있으며, 매우 고온이므로 화상을 입을 우려가 있습니다. 꼭 내열장갑을 끼고 작업하십시오.
* 가열 중 agarose gel buffer가 끓는 것을 방지하기 위해서 buffer volume의 2~5배 달하는 삼각플라스크나 비커를 사용하는 것이 좋습니다.
4. Agarose gel buffer를 약 60℃정도까지 식힙니다.
* 고온의 agarose gel buffer를 gel tray에 넣으면 gel tray가 변형될 수 있으니 꼭 식혀주십시오.
5. 적당한 온도로 식힌 agarose gel buffer를 gel tray에 흘려줍니다.
* Gel 안에 공기가 들어가지 않도록 천천히 살며시 따라 넣습니다.
* 공기가 들어간 경우에는 tip 끝으로 톡 찔러서 공기를 제거합니다.
6. Gel 용액이 굳기 전에 gel tray에 comb을 세팅합니다.
7. 이물질이 들어가지 않도록 랩이나 은박지를 씌우고 실온에서 30~60분 정도 거치하여 gel을 굳힙니다. 제작한 gel은 1× WSE-7050 EzRun TAE 또는 1× WSE-7051 EzRun TBE에 담가서 약 1주일 동안 냉장보관이 가능합니다.
4-3. 전기영동
1. 제작한 agarose gel을 gel tray째로 전기영동조 (WSE-1710 Submerge-Mini)에 넣습니다.
* Gel tray에 묻은 여분의 gel은 제거합니다.
2. 전기영동조에 running buffer (gel 제작에 사용한 것과 동일한 buffer)를 200 ~ 230 mL 넣습니다.
3. 조제한 샘플을 공기가 들어가지 않도록 천천히 loading합니다.
4. 상부 cover를 닫습니다.
5. Voltage와 시간을 설정하고 시작버튼을 눌러 전기영동을 시작합니다. (100V 기준, 약 30분)
ATTO의 Advice!
Running buffer의 volume은 gel 윗면보다 1 ~ 3 mm 위까지 넣는다!
Running buffer의 양이 너무 많으면 gel 윗면의 buffer에 흐르는 전기가 많아지기 때문에 전기영동 시간이 길어집니다.
또한 전기영동 패턴이 일그러지는 원인이 되기도 하기 때문에, running buffer 양을 너무 많이 넣는 것은 주의가 필요합니다.
4-4. Gel staining, 촬영
1. 50 mL의 1× WSE-7050 EzRun TAE 또는 1× WSE-7051 EzRun TBE에 WSE-7130 EzFluoroStain DNA를 5 μL 첨가하여 혼합합니다.
* WSE-7130 EzFluoroStain DNA가 완전히 용해되지 않고, 불용물이 나타날 수 있습니다. 이 경우, 먼저 증류수 500 μL로 WSE-7130 EzFluoroStain DNA 5 μL를 희석한 후에 1× WSE-7050 EzRun TAE 또는 1× WSE-7051 EzRun TBE를 첨가하여 50 mL의 staining solution을 제작합니다.
2. 상부 cover를 열고, gel을 gel tray째로 꺼냅니다.
* 전기영동 직후에는 running buffer가 뜨거울 수 있습니다. 화상에 주의하십시오.
3. 수지제 용기에 staining solution을 넣고 gel을 넣어 침지시킵니다. 이 때, gel tray는 빼고 gel만 staining solution에 넣습니다.
* 반드시 수지제 용기를 사용합니다. 유리용기를 사용할 경우, 형광시약이 유리에 흡착됩니다.
4. 용기를 은박지 등으로 차광하고 실온에서 10~30분간 incubation합니다.
5. Incubation 후 gel을 조심스럽게 꺼냅니다.
* 별도의 destaining 과정은 필요 없습니다. Staining 후 staining solution은 4℃에서 약 1주일간 차광하여 보관이 가능합니다.
6. 꺼낸 gel은 촬영용 tray 또는 랩 위에 올려놓습니다.
7. Gel 촬영 장치에 gel을 세팅하고 Cyan LED 또는 UV 광원으로 촬영합니다. (UV excitation: 260 ~ 370 nm, 500 ~ 580 LP filter / Cyan LED excitation: 440 ~ 500 nm, 500 ~ 580 LP filter)
4-5. 시약을 직접 조제하는 경우
아래 표는 agarose gel electrophoresis에 사용하는 주요 시약의 조성입니다.
보다 재현성이 높고 간편한 실험을 할 때에는 ATTO의 시약을 사용해주십시오.
| Reagents | Composition |
|---|---|
| Loading buffer (5× conc.) | 50% Glycerol, 1 mM EDTA (pH 8.0), 0.25% Bromophenol blue, 0.25% Xylene Cyanol FF |
| TAE buffer (50× conc.) | 2 M Tris, 1 M Acetic acid, 50 mM EDTA |
| TBE buffer (10× conc.) | 500 mM Tris, 485 mM Boric acid, 20 mM EDTA |
| Staining solution | 10 mg/mL EtBr, 1× TAE or TBE |
Staining에 EtBr을 사용할 경우, 아래와 같은 순서로 실험합니다.
* EtBr은 발암물질이므로, 인체에 접촉하지 않도록 취급에 주의하십시오.
1. 50 mL의 1× WSE-7050 EzRun TAE 또는 1× WSE-7051 EzRun TBE에 50 μL의 EtBr (10 mg/mL)을 첨가하여 혼합합니다.
2. Staining solution에 gel을 침지시키고 은박지 등으로 차광하면서 5~30분간 staining합니다.
3. Staining 후에 gel을 조심스럽게 꺼냅니다. Background가 높을 떄는 증류수에 담가 30~60분간 destaining합니다.
4. Gel imaging system에 gel을 세팅하여 UV를 이용하여 촬영합니다.
5. 참고 결과 · Tip
ATTO 제품을 사용하여 실시한 agarose gel electrophoresis의 실험예와 agarose gel electrophoresis에 관한 tip을 소개합니다.
실험예1. Running buffer의 비교

Agarose gel electrophorsis에 주로 사용되는 running buffer는 1× WSE-7050 EzRun TAE와 1× WSE-7051 EzRun TBE, 이 2가지입니다. 10 kbp 이상의 큰 size의 DNA를 분리하고 싶을 경우에는 TAE buffer를 사용합니다. TAE는 완충능력이 낮아서 단시간 전기영동에 적합합니다. 또한 linear double-stranded DNA는 TBE 보다 TAE에서 10% 정도 더 빠르게 이동하는 것으로 알려져 있습니다. 가격은 TBE보다 TAE가 훨씬 저렴합니다.
1 kbp 이하의 작은 DNA로 전기영동 후 DNA를 추출하지 않거나 회수율에 신경쓰지 않는 경우에는 TBE buffer를 사용합니다. TBE는 완충능력이 높고 이동도가 작기 때문에 작은 fragment (< 1 kbp)에 대하여 보다 높은 해상도를 얻을 수 있어 밴드가 선명하게 보입니다.
위 그림은 WSE-7050 EzRun TAE 또는WSE-7051 EzRun TBE를 사용한 1.5% agarose gel에 DNA ladder를 loading하고 WSE-1710 Submerge-Mini를 사용하여 150V에서 20분간 전기영동한 결과입니다. Staining은 WSE-7130 EzFluoroStain DNA를 이용하여 CyanLED로 excitation하여 촬영하였습니다. 이와 같이, TAE buffer는 고분자 분리, TBE buffer는 저분자 분리에 적합함을 알 수 있습니다.
Tip 1. Loading buffer의 색소
Loading buffer에는 sample이 well에 균등하게 가라앉도록 Glycerol 등의 비중첨가제와 sample에 색을 입혀 gel에 loading되어 있는지를 쉽게 확인할 수 있도록 색소가 첨가되어 있습니다. 색소는 전기영동의 진행 상태를 확인하기 위해서도 매우 중요하지만 첨가된 색소에 따라 전기영동의 속도가 다릅니다. 어떤 색소를 사용하는지는, 분리하고자 하는 DNA의 크기나 개인의 취향에 따라 선택합니다. (아래 표 참조)
ATTO의 WSE-7040 EzApply DNA에는 BPB와 Red dye가 첨가되어 있습니다. (아래 그림 참조) 특히 Red dye는 Orange G보다 빠르게 전기영동이 진행되기 때문에, 전기영동의 가장 아래쪽 지표가 되어 band가 빠져나가는 실수를 줄일 수 있습니다. 또한 비중첨가제로 Ficoll을 사용하기 때문에 Glycerol을 첨가한 buffer보다 명료하고 sharp한 band를 얻을 수 있습니다.
| Pigment name | Color | Mobility* |
|---|---|---|
| Xylene Cyanol FF (XC) | Light blue | Approx. 4 kbp |
| Bromophenol Blue (BPB) | Blue | Approx. 300 bp |
| Orange G | Orange | Approx. 50 bp |
* 0.5× TBE/0.5 ~ 1.4% Agarose gel
전기영동 후 gel과 색소의 위치

Tip 2. Agarose gel staining
EtBr 등에 의한 형광염색은 UV 등을 조사하여 형광물질을 excitation시키면 빛을 내서 band를 가시합니다. 형광물질은 핵산에 특이적으로 결합하며 그 결합량은 핵산의 분자량이나 농도에 비례합니다. 즉, 분자량이 크고 양이 많은 band는 보다 강한 빛을 내고, 분자량이 작고 양이 적은 band는 형광이 약해집니다.
EtBr은 gel에 침투되는 속도가 빨라 단시간 염색에도 충분한 감도를 얻을 수 있습니다. 하지만 EtBr은 발암물질이고, excitation에 UV가 필요하기 때문에 EtBr에 의한 gel staining은 인체에 매우 위험한 작업입니다. 또한 UV조사에 의해 핵산이 분해되어 버리기 때문에 UV를 계속 조사하면 형광은 서서히 약해져, 결국 band가 소실됩니다.
ATTO의 DNA 검출용 형광염색시약 WSE-7130 EzFluoroStain DNA는 EtBr보다 낮은 background로 고감도로 검출이 가능합니다. Excitation 광원으로 Cyan LED나 Blue LED를 사용할 수 있어서 UV보다 안전하고 높은 감도로 검출이 가능합니다. 또한 LED광원에서의 excitation은 UV처럼 핵산을 분해하지 않기 때문에 gel 분리 후 핵산의 회수율이 향상된다는 장점도 있습니다.
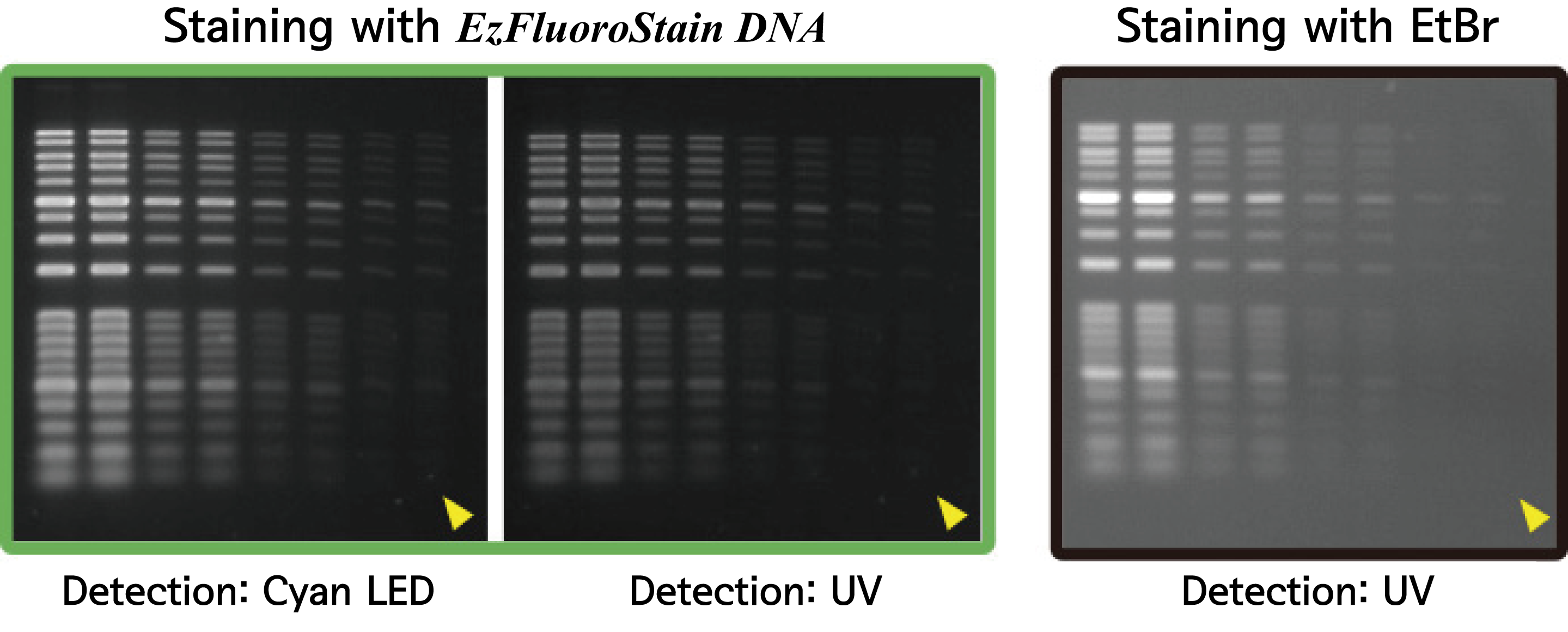
위의 사진은 WSE-7130 EzFluoroStain DNA와 EtBr로 staining한 gel을 Cyan LED 또는 UV로 검출한 결과입니다. WSE-7130 EzFluoroStain DNA로 staining하고 Cyan LED로 excitation한 gel이 가장 고감도로 band가 검출되고 있음을 알 수 있습니다.
Related Products
Tips for Electrophoresis
- Basic operation of SDS-PAGE (Polyacrylamide Gel Electrophoresis)
- Method for extracting protein from tissue or cell
- Sample preparation for electrophoresis
- Preparation of polyacrylamide gel
- Polyacrylamide gel electrophoresis (PAGE)
- Principles and method of the 2-dimensional electrophoresis
- Protein electrophoresis gel staining
- Agarose gel electrophoresis (horizontal electrophoresis)
- How to choose the power supply





