Western blotting (Blocking)
1. 개요
Western blotting의 PVDF membrane 등은 단백질이 결합하기 쉬운 소재입니다. Blocking은 transfer된 단백질 밴드가 membrane 표면에 항체나 검출용 효소, 다른 단백질 등이 비특이적으로 결합하는 것을 방지합니다. Blocking reagent의 선택에 따라 검출 감도나 background의 signal이 크게 영향을 받기 때문에 실험결과가 완전히 바뀔 수 있습니다.
이번에는 ATTO의 제품을 사용한 Western blotting의 blocking 특징에 대해 알아보겠습니다.
2. 실험 과정
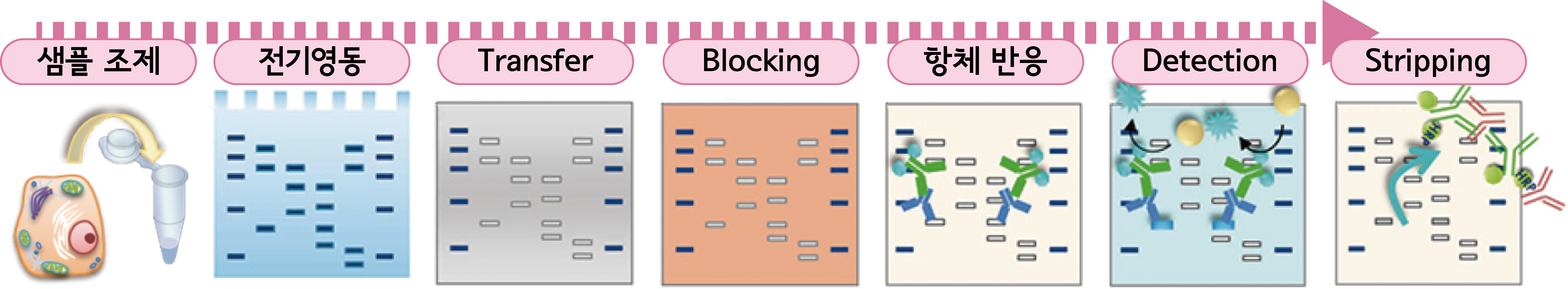
1. 샘플 조제
세포, 조직이나 미생물 등에서 RIPA Lysis buffer나 SDS sample buffer를 이용하여 단백질을 추출하여 SDS처리 및 환원 처리를 합니다.
* 사용하는 제품 (Fractionation / Extraction Kit, Sample preparation solution)
AE-1430 EzApply, WSE-7010 EzLabel FluoroNeo, WSE-7420 EzRIPA Lysis kit, etc.
* 사용하는 제품 (Block incubator)
WSC-2615 MyMiniBLOCK C&H, etc.
2. 전기영동
SDS-Polyacrylamide gel electrophoresis로 단백질을 분리합니다. 목적하는 단백질이 gel의 중앙에 올 수 있도록 acrylamide의 농도를 선택합니다. 목적하는 단백질의 분자량이 불분명한 경우, gradient gel을 사용합니다. 또한 blotting 효율을 판단하기 용이하도록 prestained protein marker 등을 사용합니다. 발현량을 비교할 경우에는 control sample을 함께 전기영동합니다.
* 사용하는 제품 (Gel, Running buffer)
e-PAGEL, AE-1410 EzRun, etc.
* 사용하는 제품 (전기영동장치, Power supply)
WSE-1165 Mini-Slab, WSE-3400 myPower H300, etc.
3. Transfer
전기영동으로 분리된 단백질을 gel에서 PVDF membrane으로 이동시킵니다.
* 사용하는 제품 (Transfer buffer)
AE-1465 EzFastBlot, WSE-7210 EzFastBlot HMW, etc.
* 사용하는 제품 (Blotter, Power supply)
WSE-4125 PoweredBLOT 2M, etc.
4. Blocking
단백질 밴드가 없는 membrane 표면에 항체가 비특이적으로 결합하지 않도록 차단합니다.
* 사용하는 제품 (Blocking solution)
AE-1475 EzBlock Chemi, etc.
* 사용하는 제품 (Shaker)
WSC-2400 SeesawShaker atto
5. 항체 반응
Target protein에 대한 항체 (1차 항체) 및 HRP 등 효소로 표지된 항체 (2차 항체)와 반응합니다.
* 사용하는 제품 (항체 희석 및 Wash buffer)
WSE-7230 EzTBS, WSE-7235 EzTween, etc.
* 사용하는 제품 (Shaker)
WSC-2400 SeesawShaker atto
6. Detection
2차 항체에 표지된 효소와 반응하여 발색 또는 발광하는 기질을 이용하여 target protein 밴드를 간접적으로 검출합니다.
* 사용하는 제품 (발광/발색 시약)
WSE-7120 EzWestLumi plus, etc.
* 사용하는 제품 (Chemiluminescence imaging system)
WSE-6370 LuminoGraph III Lite, etc.
7. Stripping
Membrane에 결합한 항체를 떼어내고, 동일한 blotting membrane에서 다른 target protein을 검출할 수 있도록 합니다.
* 사용하는 제품 (Stripping solution)
WSE-7240 EzReprobe
* 사용하는 제품 (Shaker)
WSC-2400 SeesawShaker atto
3. 실험 방법
3-1. 전기영동 ~ Transfer
목적하는 단백질의 분자량을 분리할 수 있는 적절한 acrylamide 농도의 gel을 사용하여 목적단백질 transfer에 적합한 transfer buffer와 방법을 선택합니다.
전기영동
| 고분자의 경우 | 저분자의 경우 |
|---|---|
| 가능한 한 낮은 농도의 acrylamide를 사용합니다. 단, 7.5% 이하의 acrylamide gel은 취급이 어려우므로 gradient gel을 사용합니다. | 일반적으로는 고농도의 acrylamide gel을 사용하지만 이 경우, transfer 효율이 현저히 떨어집니다. 그래서 10% 내외의 acrylamide gel과 저분자밴드가 잘 분리될 수 있는 running buffer, WSE-7065 EzRun MOPS를 사용하여 단백질을 분리합니다. 이 경우, acrylamide 농도가 균일하므로 blotting 전후의 gel 변형을 줄일 수 있고, 고효율로 전사할 수 있습니다. |
Transfer
| 고분자의 경우 | 저분자의 경우 |
|---|---|
| 150 kDa 이상의 고분자는 transfer 효율이 현저히 나빠지므로 고분자 전용 transfer buffer인 WSE-7210 EzFastBlot HMW를 이용하여 Semi-dry blotting을 합니다. 또한 transfer 전에 gel을 transfer buffer로 equilibrium (약 30분간)을 하면 단백질의 transfer 효율이 높아질 수 있습니다. 단, equilibrium 시간이 길어지면 저분자 단백질 밴드가 gel에서 빠져나가거나 밴드가 diffusion되므로 주의가 필요합니다. | 저분자 단백질(~200 kDa)을 transfer할 경우, AE-1465 EzFastBlot을 사용하면 약 10분안에 단시간에 고효율로 transfer할 수 있습니다. QBlot kit는 blotting membrane이나 filter paper의 준비가 불필요하므로 작업시간을 더욱 단축할 수 있고, 보다 고효율로 transfer할 수 있습니다. (Transfer 소요시간 최단 5~10분) 저분자인 경우 blotting membrane에서 빠져나갈 수 있으므로 pore size가 0.2 μm인 PVDF membrane을 사용합니다. 또한 transfer buffer에 methanol을 첨가할 경우 membrane에 대한 단백질의 흡착력이 높아집니다. (EzFastBlot series는 methanol을 첨가하지 마십시오). |
3-2. Blocking의 준비
전기영동부터 트랜스퍼를 하는 동안 blocking을 준비합니다.
Blocking solutions
Mini gel size 1장당 50 mL 준비합니다. 아래 표를 참고하여 목적 단백질의 검출법 등에 따라서 blocking solution을 선택합니다.
| Blocking solution | Skim milk | AE-1475 EzBlock Chemi | AE-1476 EzBlock BSA | AE-1477 EzBlock CAS |
|---|---|---|---|---|
| Major components | Bovine skim milk | Synthetic polymer | Bovine albumin | Bovine casein |
| Reaction time | 30~60 min | 5~60 min | 15~60 min | 15~60 min |
| Avidin-biotin | × | ○ | ○ | × |
| Phosphorylated protein | × | ○ | ○ | × |
* EzBlock Chemi/BSA/CAS는 증류수로 5배 희석하여 사용합니다. EzBlock BSA/CAS는 시약에 동봉된 Tween 20도 1/100량 첨가합니다.
* Skim milk는 1~5% 농도로 TBS-T 또는 PBS-T에 용해하여 blocking solution으로 사용합니다.
Washing buffer
Mini gel size 1장당 50 mL 정도 준비합니다.
| TBS-T | PBS-T |
|---|---|
| WSE-7235 EzTween (혹은 0.01~0.1% Tween 20) 함유한 1× WSE-7230 EzTBS (혹은 50 mM Tris, 137 mM NaCl, 2.7 mM KCl / pH 7.4) | WSE-7235 EzTween (혹은 0.01~0.1% Tween 20) 함유한 1× WSE-7430 EzPBS (혹은 137 mM NaCl, 2.7 mM KCl, 81 mM Na₂HPO₄, 14.7 mM KH₂PO₄) * 인산화 단백질을 검출할 때에는 가급적 TBS-T를 사용합니다. |
Antibody
Mini gel size 1장당 5~20 mL 준비합니다. 일반적으로 목적하는 단백질에 대한 primary antibody와 검출용 효소나 형광이 표지된 secondary antibody를 준비합니다. Primary antibody에 직접 표지되어 있는 경우에는 secondary antibody가 필요하지 않습니다. Antibody의 희석률은 antibody 및 검출시약의 첨부문서를 참고하여 결정합니다. 샘플 양이나 시간에 여유가 있는 경우에는 dot blotting으로 적절한 항원의 검출 감도가 되도록 희석률을 검토합니다. 또한 antibody의 의석은 antibody reaction 직전에 진행합니다. Antibody를 희석한 상태로 장시간 두면 활성을 잃을 수 있습니다.
3-3. Membrane의 blocking 방법
아래 순서에 따라서 membrane을 blocking처리 합니다.
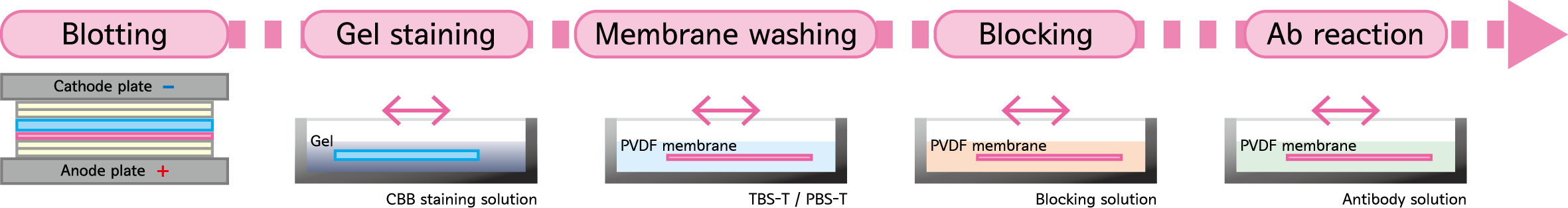
Blotting
Blotting 종료 후 transfer 장치를 열고, gel과 blotting membrane을 회수합니다.
Gel staining (optional)
Transfer 효율을 확인하기 위해 gel에 남아있는 단백질을 CBB staining solution으로 staining합니다.
Membrane washing
Blotting membrane을 TBS-T 또는 PBS-T에 담근 후 20~30초간 가볍게 세척합니다.
* 세척 후의 blotting membrane은 건조한 후 밀폐하여 -20℃에서 보관할 수 있습니다.
Blocking
Blotting membrane을 Blocking solution에 담그고 실온에서 ~30분간 shaking하면서 incubation합니다.
* Blocking 시간이 길어지면 overblocking이 되고, 검출 감도가 낮아집니다. 반대로 blocking 시간이 너무 짧으면 충분히 blocking되지 않고 background가 높게 나오거나, 비특이적 단백질 밴드가 나타나는 요인이 됩니다.
Antibody reaction
Blocking 종료 후 희석한 antibody solution에 담가서 antibody reaction을 진행합니다.
참고 데이터
실험 예1. Blocking solution에 따른 차이
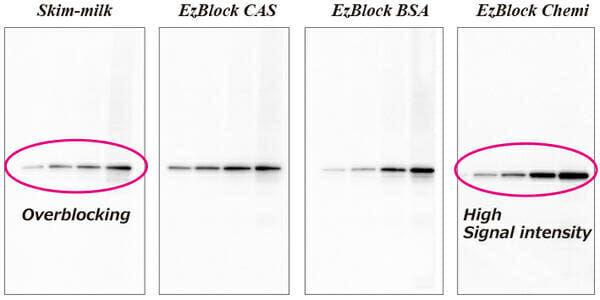
위의 사진은 blocking solution에 의한 차이가 실험결과에 미치는 영향을 검토한 결과입니다. 왼쪽부터 3% skim milk, AE-1477 EzBlock CAS, AE-1476 EzBlock BSA, AE-1475 EzBlock Chemi입니다. Hela cell 추출액을 serial dilution하여 전기영동하고, AE-1465 EzFastBlot으로 ClearBlot P plus membrane에 transfer하였습니다. 각각의 blocking solution으로 30분간 blocking 처리를 한 후, SMAD2 단백질에 대한 antibody로 antibody reaction을 하여 WSE-7120 EzWestLumi plus로 검출하였습니다.
Skim milk를 사용한 경우, signal이 약해져 낮은 농도의 밴드가 검출하기 어려워집니다(overblocking). AE-1477 EzBlock CAS는 주성분이 skim milk와 유사한 casein이지만, 정제된 casein 단백질을 사용하여 저농도의 밴드도 overblocking되지 않고 검출이 가능합니다. 반면 AE-1475 EzBlock Chemi는 주성분이 단백질이 아닌 합성 polymer로 이루어져 background는 억제하면서 비특이적인 밴드가 검출되지 않아 단백질 농도에 비례하여 signal 검출이 가능합니다.
이와 같이 blocking solution은 단백질의 검출감도나 signal 강도에 큰 영향을 주는 것을 알 수 있습니다.
실험 예2. Blocking 시간에 따른 차이
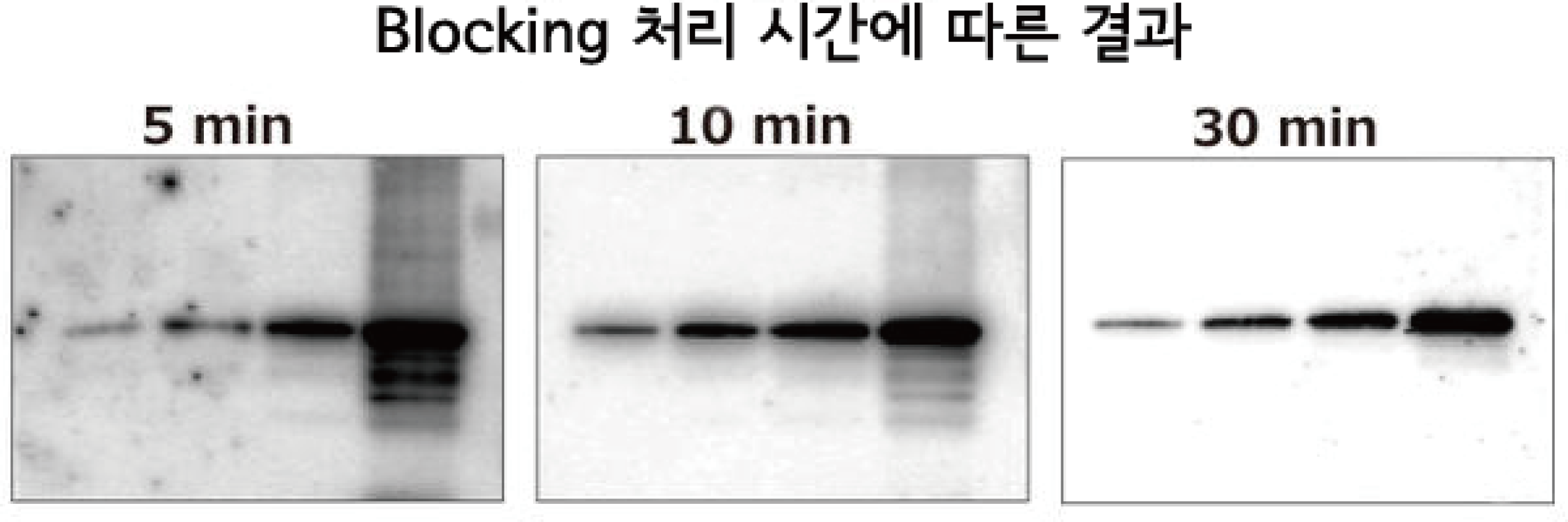
위 사진은 blocking 처리시간 (왼쪽부터 5분, 10분, 30분간 incubation)이 실험결과에 미치는 영향을 검토한 결과입니다. Hela cell 추출액을 serial dilution하여 전기영동하고, AE-1465 EzFastBlot으로 ClearBlot P plus membrane에 transfer한 후, 각각 AE-1475 EzBlock Chemi에서 5~30분간 blocking 처리한 후 SMAD2 단백질에 대한 항체로 antibody reaction을 시행하여 WSE-7120 EzWestLumi plus로 검출하였습니다.
Blocking 시간이 5분 이하로 짧으면 background가 높고, 비특이적인 밴드가 검출되지만 적절한 시간동안 blocking 처리를 하면 background를 낮출 수 있고, 또한 각 밴드를 명확하게 검출할 수 있습니다.
AE-1475 EzBlock Chemi를 사용할 경우 blocking 능력이 좋아서 위의 결과와 같이 10분간의 blocking에도 충분한 blocking 효과를 볼 수 있습니다. 물론 30분간 blocking 처리를 하면 비특이적인 밴드가 검출되지 않고 background가 더욱 깨끗하게 검출됩니다. 하지만, 낮은 농도의 단백질 밴드는 signal 감도가 약간 약해질 수 있습니다.
물론 이러한 결과는 blocking 시간만의 영향이라기 보다는, blocking agent와 membrane 및 샘플에 따라서 달라질 수 있습니다만, blocking 시간은 단백질의 검출 감도나 강도에 큰 영향을 주는 것을 알 수 있습니다.
실험 예3. Stripping과 blocking solution
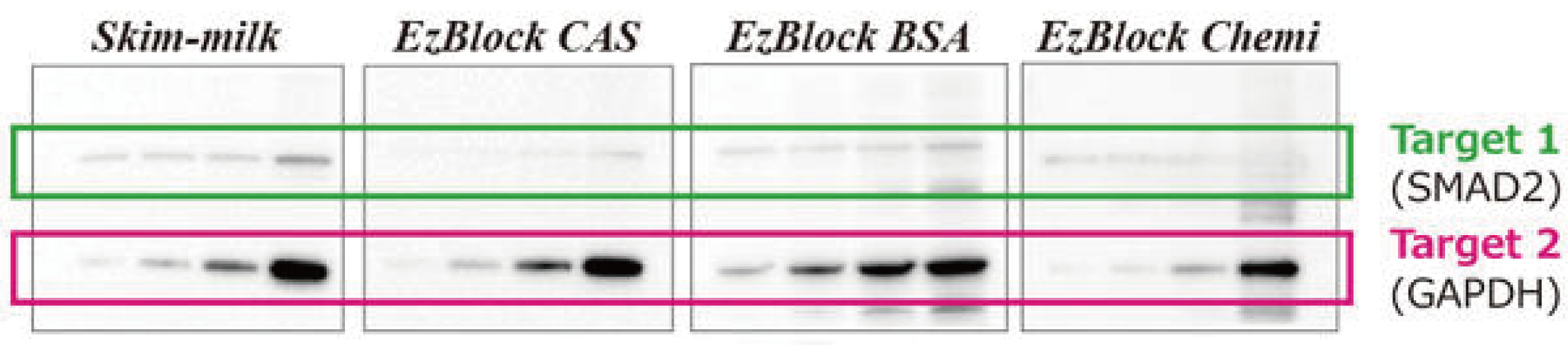
위 사진은 WSE-7240 EzReprobe로 처음 검출할 때 사용한 antibody를 stripping 후에 다양한 blocking solutions (왼쪽부터 3% skim milk, AE-1477 EzBlock CAS, AE-1476 EzBlock BSA, AE-1475 EzBlock Chemi)로 다시 blocking하여 처리할 경우, 실험 결과에 어떠한 영향을 미치는지 확인하였습니다.
Hela cell 추출액을 serial dilution하여 전기영동하고, AE-1465 EzFastBlot으로 ClearBlot P plus membrane에 전사한 후, AE-1475 EzBlock Chemi로 30분간 blocking 처리한 후, SMAD2 단백질에 대한 항체로 항체반응을 시행하여 WSE-7120 EzWestLumi plus로 검출하였습니다. WSE-7240 EzReprobe에 10분간 incubation하여 항체를 모두 stripping하고 다시 blocking 처리하였습니다. 그 후, GAPDH에 대한 antibody와 반응하여 최종적으로 얻은 signal을 WSE-7120 EzWestLumi plus로 검출한 결과입니다.
위의 결과와 같이 skim milk를 사용하였을 때에는 Target 1의 비특이적 signal이 제대로 stripping되지 않고, AE-1476 EzBlock BSA를 사용한 경우에는 비특이적 밴드가 검출되었습니다. 한편 AE-1477 EzBlock CAS를 사용하면 비특이적 밴드의 검출이 억제되고, Target 2의 signal이 충분한 강도로 검출되었습니다. 이와 같이 stripping 후에 reprobing 전에 행하는 blocking에는 AE-1477 EzBlock CAS를 사용하면 비특이적 밴드의 검출과 background는 억제하고, target protein의 signal은 깨끗하게 얻을 수 있습니다.
실험 예4. Stripping과 blocking 시간
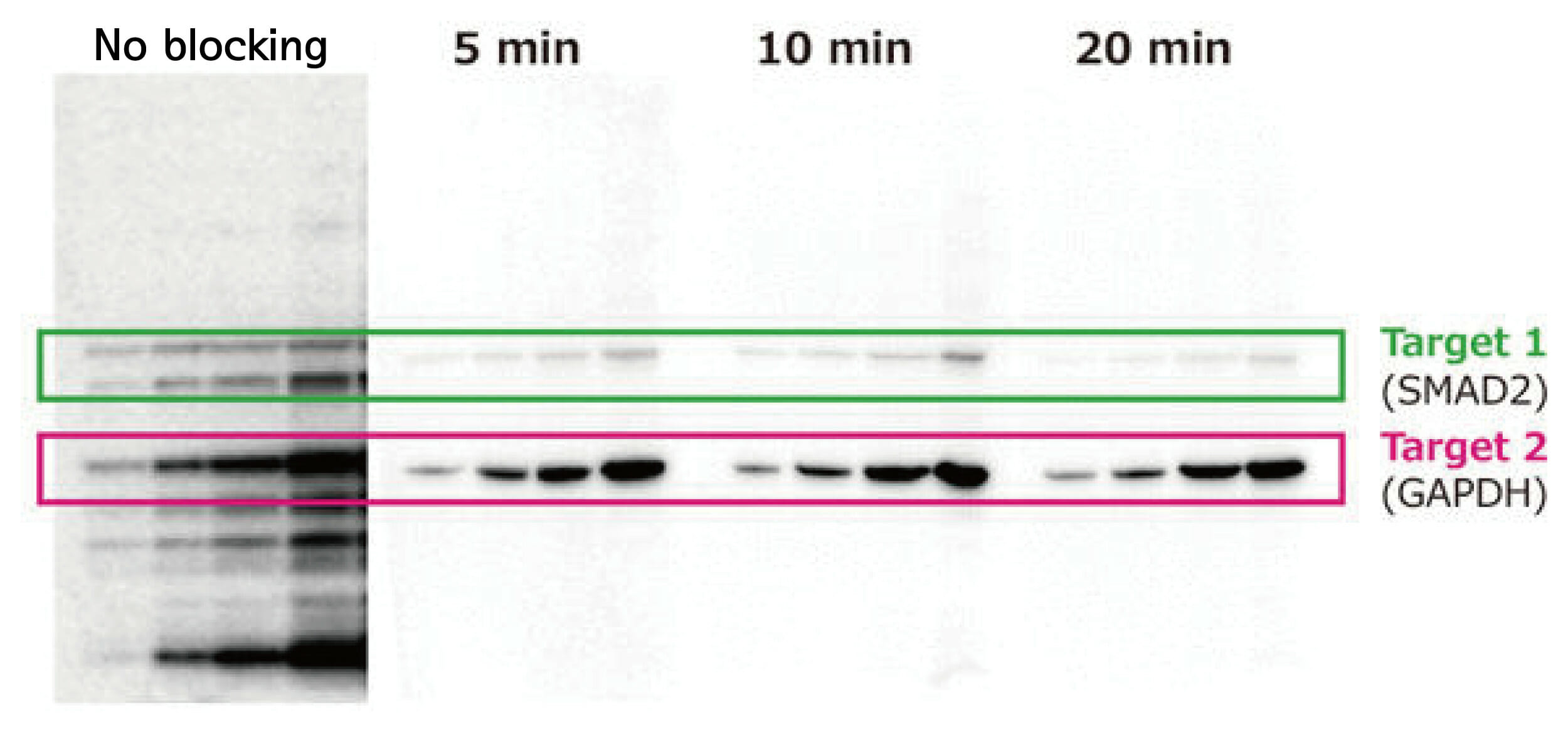
위 사진은 WSE-7240 EzReprobe에 의해 최초 detection할 때에 사용한 antibody를 stripping 후에 다시 blocking을 할 때에, blocking 시간에 따라 실험 결과에 어떠한 영향을 미치는지 검토한 결과입니다.
Hela cell 추출액을 serial dilution하여 전기영동하고, AE-1465 EzFastBlot으로 ClearBlot P plus membrane에 전사한 후, AE-1475 EzBlock Chemi로 30분간 blocking 처리한 후, SMAD2 단백질에 대한 항체로 항체반응을 시행하여 WSE-7120 EzWestLumi plus로 검출하였습니다. WSE-7240 EzReprobe에 10분간 incubation하여 항체를 모두 stripping하고 다시 AE-1477 EzBlock CAS로 5분간, 10분간, 20분간 incubation하여 blocking을 실시하였습니다. (No-Blocking: stripping 후에 blocking 없이 antibody reaction을 실시) 그 후 GAPDH에 대한 antibody와 반응하여 최종적으로 얻은 signal을 WSE-7120 EzWestLumi plus로 검출한 결과입니다.
위의 결과와 같이 blocking을 다시 실시하지 않는 경우에는 비특이적 밴드의 signal이 매우 높게 나타났습니다. 반대로 blocking을 다시 한 경우, 5분만으로도 충분한 효과를 얻을 수 있으며, 시간을 20분까지 연장할 경우 reprobing한 Target 2의 signal 강도는 유지한 채 stripping된 항체 (Target 1)의 남은 signal이 약해져 더욱 깨끗한 결과를 얻을 수 있었습니다. 이와 같이 항체 stripping 후에 reprobing 전에 실시하는 blocking은 필수적이며, 단시간의 blocking 처리만으로도 충분한 효과를 얻을 수 있음을 알 수 있습니다.
Related products
F 0.8 렌즈 사용으로 높은 감도
편리한 Auto-exposure 촬영기능
뛰어난 정량성과 넓은 dynamic range
최대 26 × 20 cm의 넓은 촬영 면적
Tips for Western Blotting
- Basic operation of Western blotting
- Method for extracting protein from tissue or cell
- Principle and workflow of Semi-dry blotting
- Western blotting (Transfer)
- How to choose the reagents for semi-dry blotting
- Transfer method according to transfer buffer and consumables
- Western blotting (Blocking)
- Western blotting (Antibody reaction and detection)
- Normalization (Western blotting data)

