Method for extracting protein from tissue or cell
1. Introduction
“Protein”의 어원은 그리서어의 “Proteios (가장 중요한 것)”에서 유래했다고 합니다. 단백질은 생체의 구조와 기능을 담당하는 데 필수적인 존재라고 할 수 있습니다. 단백질의 기능을 연구하기 위해서는 먼저, 생체 샘플에서 단백질을 추출하여 가용화하는 것이 중요합니다. 여기에서는 아토의 제품을 사용하여 단백질을 추출하는 방법에 대해 소개하겠습니다.
▶ 주의할 점
단백질을 추출할 때 기본적인 주의점으로는
1. 샘플 선택 (신선하고 원하는 목적을 알기 쉬운 샘플 선택)
2. 온도 (일반적으로 0~4℃)
3. pH, 이온강도 (ionic strength): pH는 일반적으로 pH 4~7, 이온강도는 0.1M
4. Thiol기 (산화를 보호하기 위한 DTT 등의 환원제 첨가)
5. 안정화제의 첨가 (당이나 글리세린 등의 첨가)
6. Protease inhibitor의 첨가
7. 금속이온 chelate 등이 있습니다.
2. 대장균의 단백질 추출 방법
대장균과 같은 미생물에는 세포벽이 있기 때문에 Mammalian cell에 비해 파괴하는 것이 어렵습니다. 일반적으로는 초음파 파쇄, 동결 융해를 통한 파쇄, Lysozome등의 효소에 의한 용해 등을 통해 단백질을 추출합니다. 그러나 초음파나 동결 융해에 의한 물리적 파쇄는 조작이 번거롭고 종종 단백질이 변성되는 원인이 됩니다. ATTO의 WSE-7423 EzBactYeastCrusher는 균체에 넣고 섞는 것만으로도 단백질을 안정적으로 추출할 수 있습니다.
2-1. 실험방법
실험재료:
대장균 및 배양액
WSE-7423 EzBactYeastCrusher
증류수
마이크로 원심튜브, 피펫 tip 등
원심기, 마이크로피펫 등
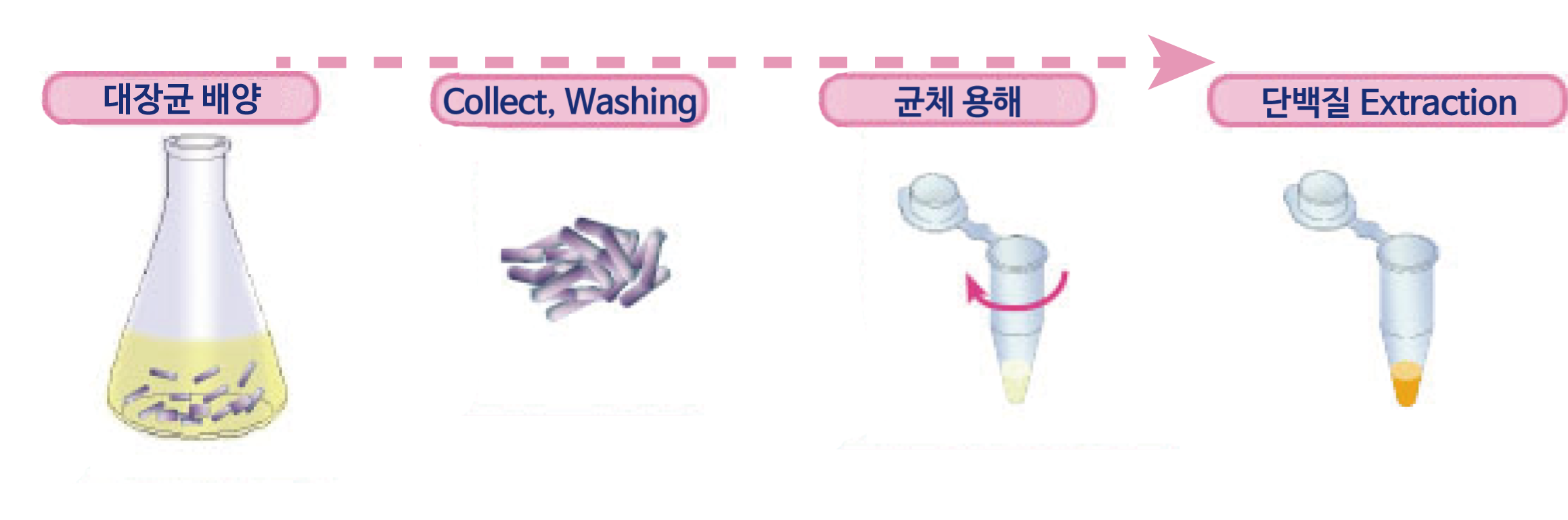
대장균 배양
대장균을 적당한 배지에서 O.D. 600=0.5~1.0이 될때까지 배양합니다. (균체량으로는 50~100 mg 상당)
* 대장균 발현 단백질을 추출하는 경우에는 발현용 대장균 및 발현 단백질에 적절한 조건에서 배양할 것을 권장합니다.
Collect, Washing
대장균을 2,000×g로 5분간 원심분리하여 상등액을 제거합니다. Pellet에 5~10mL의 증류수를 더해 현탁하여 다시 2,000×g에서 5분간 원심분리하여 상등액을 제거합니다.
* Washing후의 Pellet (균체)는 -80℃에서 동결보존 가능합니다. 일반적으로 한 번 동결하면 추출 효율이 높아집니다.
균체 용해
상등액을 제거하고 균체를 vortex하여 세포를 잘 풀어줍니다. 이 때 균체를 균일하게 잘 풀어주는 것이 중요합니다.
0.5 mL의 EzBactYeast Lysis buffer를 첨가하여 실온에 10분간 둡니다.
* EzBactYeast Lysis buffer에 미리 EzBactYeast Crusher 키트에 포함된 Protease Inhibitor와 DNase I을 첨가합니다.
단백질 Extraction
균체용해액을 4℃, 10,000×g에서 5분간 원심분리하여 상등액을 모아줍니다.
* 불용성 단백질은 Pellet에 회수됩니다. 불용성 단백질을 추출할 때에는 Pellet에 8M Urea contained buffer나 6M Guanidine-HCl contained buffer 등을 첨가해 용해하여 단백질을 추출하여 주십시오.
일반적인 대장균 단백질 추출방법
1. 대장균을 파쇄용 용액(50 mM Tris pH8.0, 500 mM NaCl, 15% glycerol, 10 mM imidazole)으로 3회 세척한다.
2. Pellet을 3배 용량의 Sonication buffer에 현탁하고, 최종농도가 1 mg/mL Lysozyme, 1 mM DTT, 0.5 mM EDTA가 되도록 첨가한다.
3. 대장균이 파쇄될 때까지 냉각하면서 초음파 파쇄를 실시한다 (현미경 등으로 확인).
4. DNase I의 최종농도가 0.1 mg/mL이 되도록 첨가한다.
5. 원심분리(10,000×g~25,000×g, 10~30분)하여 상등액을 회수한다.
2-2. 참고 데이터
실험예1: 추출 효율
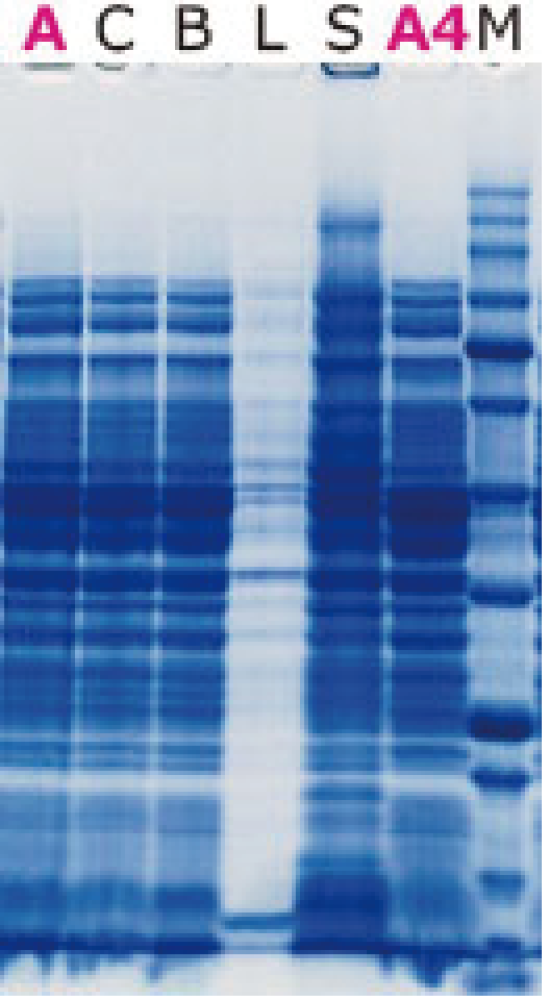
추출에 사용한 시약
A: WSE-7423 EzBactYeastCrusher (실온)
C: 타사 시판 시약
B: 타사 시판 시약
L: Lysozyme
S: SDS sample buffer
A: WSE-7423 EzBactYeastCrusher (4℃)
M: EzProtein Ladder
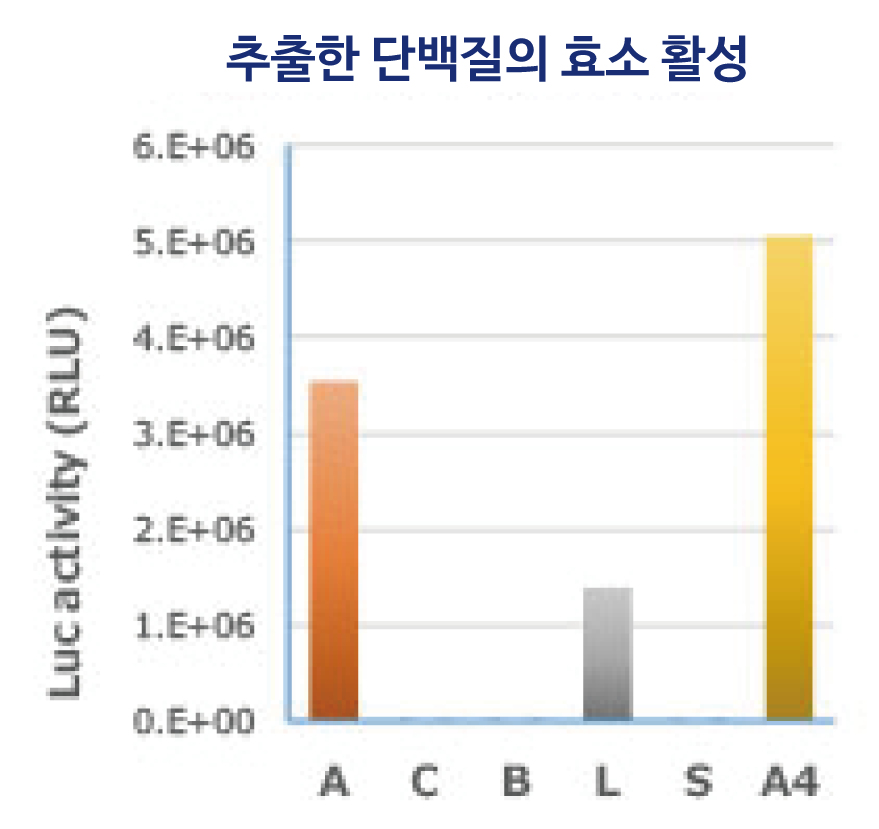
Luciferase 발현 대장균에서 위에 기재된 시약을 사용하여 단백질을 추출하고, 전기영동한 결과 (위)와 효소 활성을 측정한 결과 (왼쪽)을 나타냈습니다. WSE-7423 EzBactYeastCrusher는 실온에서도, 저온(4℃)에서도 동일하게 타사 시판 시약과 동등 이상의 추출 효율로 단백질을 회수할 수 있습니다.
또한 왼쪽의 그래프에 제시된 바와 같이 실온에서 추출한 경우에도 효소 활성을 높게 유지한 상태에서 단백질 추출이 가능함을 알 수 있습니다.
실험예2: 발현 단백질의 정제
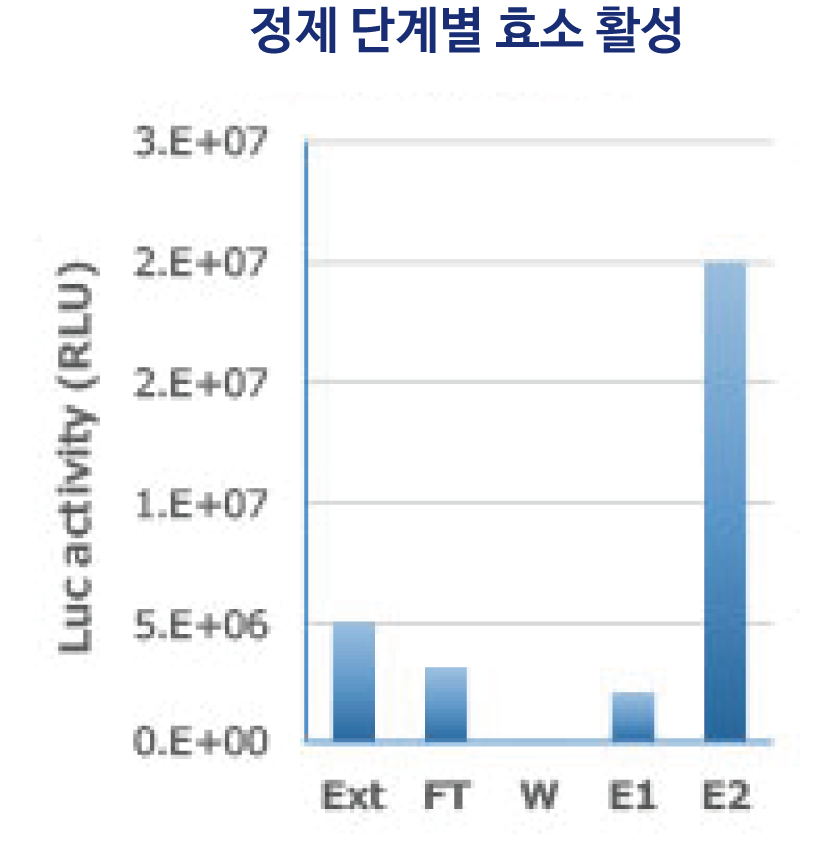
그림은 His tag-Luciferase 발현 대장균에서 WSE-7423 EzBactYeastCrusher를 사용하여 추출한 단백질을 Ni-Sepharose 컬럼으로 정제한 결과를 나타냈습니다. WSE-7423 EzBactYeastCrusher는 컬럼으로의 결합, 각 정제 스텝의 반응을 저해하지 않으며 효소 활성도 유지한 상태에서 단백질을 정제할 수 있습니다. 이와 같이WSE-7423 EzBactYeastCrusher는 대장균계 발현 단백질의 추출 및 정제에도 적합한 것으로 나타났습니다.
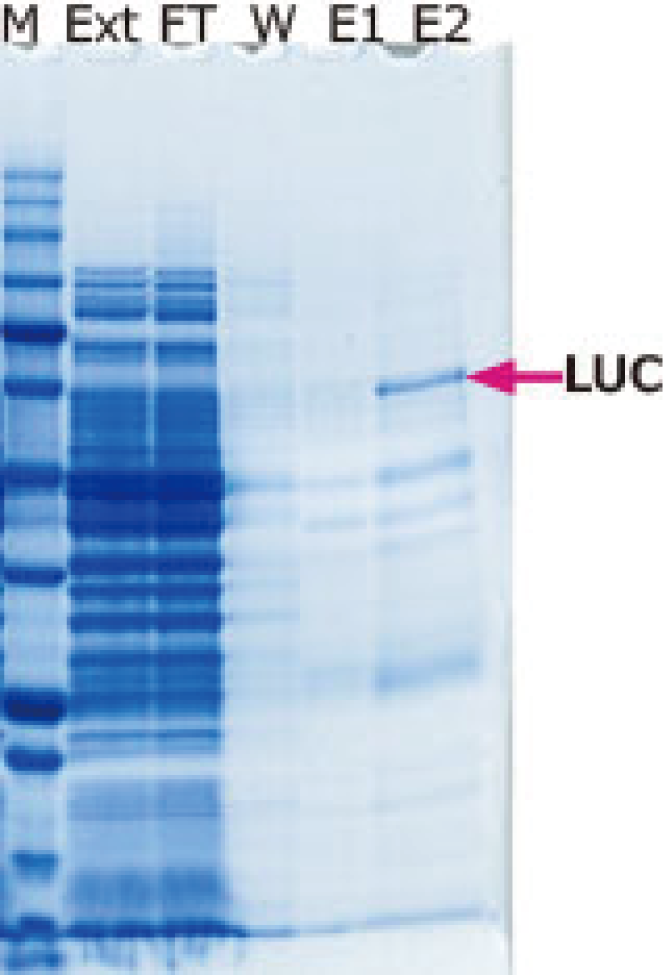
M: WSE-7020 EzProtein Ladder
Ext: Whole Extract
FT: Flow through
W: Wash
E1: Extraction 1
E2: Extraction 2 (Purified protein)
3. 효모의 단백질 추출 방법
효모에는 다당류를 주성분으로 한 경질 세포벽이 있기 때문에 대장균보다 파괴하는 것이 어렵습니다. 일반적으로는 Glass beads 등의 연마제를 첨가한 Homogenizer, French press 등의 가압감압처리에 의한 파쇄, 초음파 파쇄, Zymolyase등의 효소에 의해 Protoplast화된 이후의 용해 등이 주류입니다. 그러나 물리적 파괴는 추출 효율은 높지만 조작이 번잡하고 물리적 손상이 크며, 또 Protoplast화도 조건의 최적화가 어렵다고 합니다. ATTO의 WSE-7423 EzBactYeastCrusher는 Protease Inhibitor와 DNase I이 포함되어 있어 균체에 섞는 것만으로도 Glass beads법과 유사한 추출효율로 단백질을 안정적으로 추출할 수 있습니다. (Schizosaccharomyces pombe는 추출효율이 떨어집니다.)
3-1. 실험방법
실험재료
균체 및 배양액 (10 mL)
WSE-7423 EzBactYeastCrusher
증류수
마이크로 원심튜브, 피펫 tip 등
원심기, 마이크로피펫 등
효모 배양
효모를 적당한 배지에서 O.D.600=0.5~1.0이 될때까지 배양합니다. (균체량으로는 50~100 mg 상당)
* 발현 단백질을 추출할 경우에는 발현용 효모 및 발현 단백질에 적절한 조건에서 배양할 것을 권장합니다.
Collect, Washing
효모를 2,000×g에서 5분간 원심분리하여 집균합니다. Pellet에 5~10 mL의 증류수를 넣어 현탁하여 다시 2,000×g에서 5분간 원심분리하여 집균합니다.
* 세척 후의 Pellet은 -80℃에서 동결보존이 가능합니다. 일반적으로 한 번 동결하면 추출 효율이 높아집니다.
Pretreatment
원심분리한 상등액을 제거하고, 균체를 vortex하여 세포를 잘 풀어줍니다(중요). 0.5 mL의 Yest PreLysis buffer를 첨가하여 vortex한 후, 실온에서 5분간 정치합니다.
* 실험에 지정이 없는 경우에는, DTT를 5~50 mM 농도로 첨가하면 단백질 추출 효율이 높아집니다.
균체 용해
세포현탁액을 10,000×g에서 5초간(4℃) 원심분리하고 회수한 균체를 vortex하여 Pellet을 잘 풀어줍니다(중요).
0.5 mL의 EzBactYeast Lysis buffer를 첨가하여 실온에서 10분간 정치합니다.
* EzBactYeast Lysis buffer 에는 미리 WSE-7423 EzBactYeastCrusher에 첨부된 Protease Inihibitor 와 DNase I 를 첨가합니다.
* 추출효율을 높일 경우에는 산세척한 Glass beads (φ0.5 mm)를 사용합니다 (Schizosaccharomyces pombe는 필수).
단백질 Extraction
세포용해액을 4℃, 10,000×g에서 5분간 원심분리하여 상등액을 회수합니다.
일반적인 효모 단백질 추출방법
1. 효모를 파쇄용 용액(0.33 M Sucrose, 0.3 M Tris/pH 8.0, 1 mM EDTA, 1 mM EGTA, 2 mM DTT, 100 mM 6-Aminohexanoic acid)으로 Washing한다.
2. 파쇄용기에 균체를 넣고 용기의 40% 용량의 산세정한 Glass beads를 첨가한다.
3. Bead homogenizer에 장착하고 Pulse를 1분동안, 총 3~5분간 파쇄한다.
4. 파쇄 후, 필요할 경우 1 M Tris/pH 7.4를 첨가하여 pH를 조정한다.
5. 14,000×g에서 30분간 원심분리하여 상등액을 회수한다.
3-2. 참고 데이터
실험예3: 효모 단백질 추출 효율의 비교
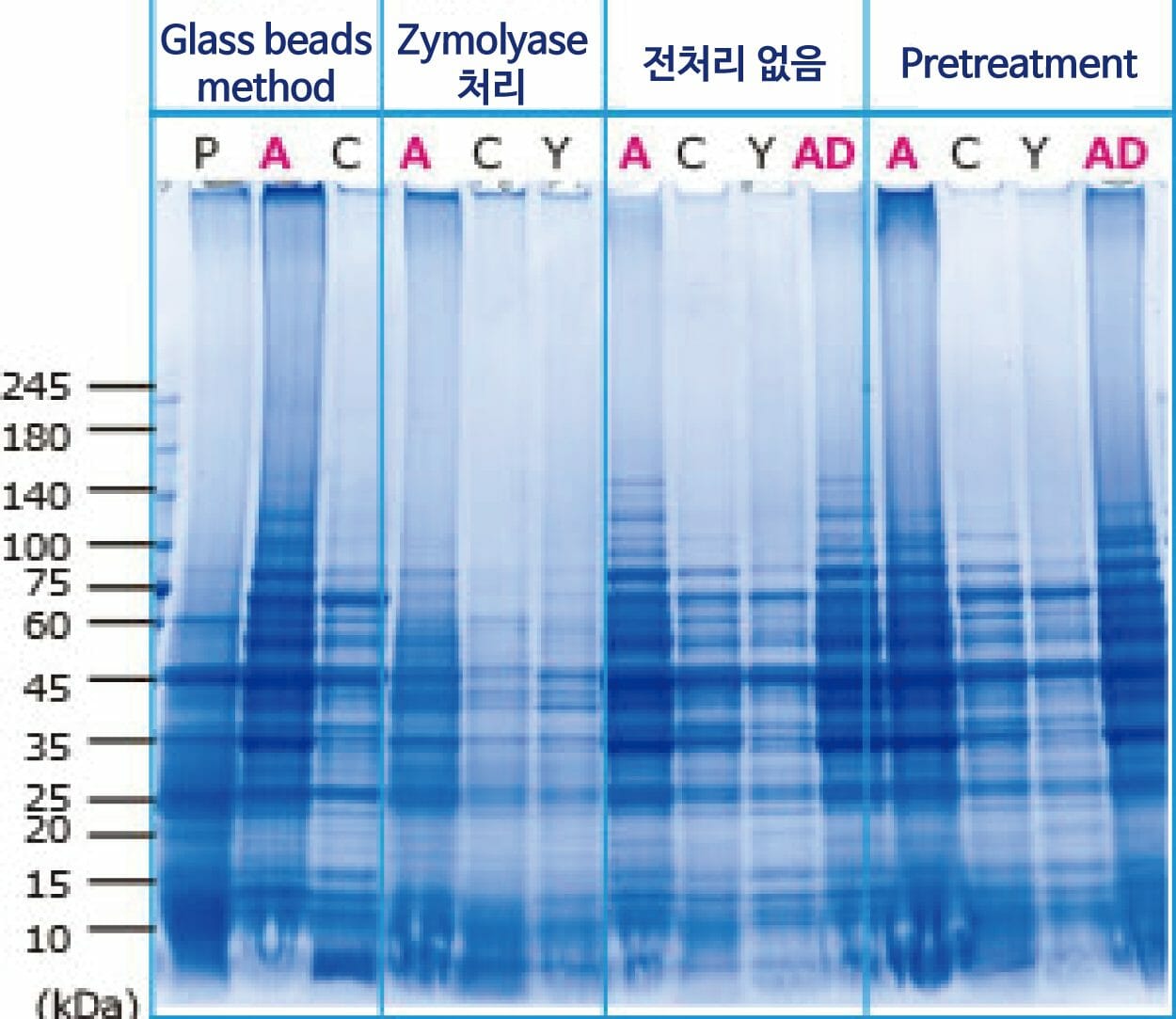
추출에 사용한 시약
P: PBS
A: WSE-7423 EzBactYeastCrusher
C: 타사 시판 시약
Y: 타사 시판 시약
AD: WSE-7423 EzBactYeastCrusher + 5 mM DTT
이 사진은 YPD 배지에서 배양한 Saccharomyces cerevisiae 5 mL의 배양액에서 세포를 회수하고, 위에 기재한 방법으로 단백질을 추출하여 전기영동한 결과입니다. Glass beads법은 세포의 약 2.5배 용량의 Glass beads와 각 추출액 0.2 mL을 첨가하고 10분간 vortex하여 단백질을 추출하였습니다. Zymolyase처리법은 5 mg/mL의 Zymolyase를 37℃에서 30분간 처리한 후, 세포를 PBS로 Washing하고 세포에 각 추출액을 0.2 mL 첨가하여 10분간 Incubation하여 단백질을 추출하였습니다. 전처리 없음과 Pretreatment는 세포에 각 추출액을 0.2 mL 첨가하여 10분간 Incubation하여 단백질을 추출하였습니다. Pretreatment는 단백질 추출 전에 WSE-7423 EzBactYeastCrusher에 포함된 Pre-Lysis buffer를 세포에 첨가하여 10분간 Incubation하였습니다. Glass beads법, Zymolyase법을 포함하여 WSE-7423 EzBactYeastCrusher에서 추출한 lane(A)의 단백질은 기타 추출시약에 비해 단백질 밴드가 많고, 농도도 높은 것으로 나타났습니다. 특히, 용출이 어려운 고분자 영역의 단백질 추출 효율이 높고, 다양한 단백질이 고효율로 용출될 수 있음을 알 수 있습니다.
실험예4: 효모 추출 단백질의 Immunoprecipitation (면역침강)
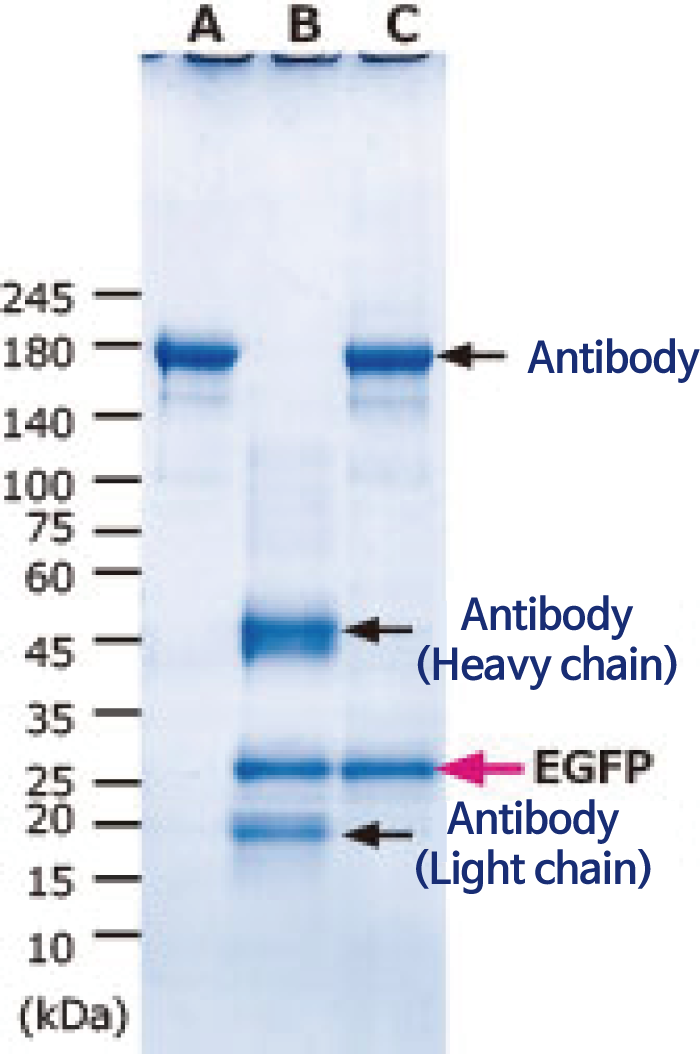
A: Non-induced 효모추출단백질로 IP
B: Induced 효모추출단백질 (with DTT)로 IP
C. Induced 효모추출단백질 (without DTT)로 IP

그림은 V5 tag-EGFP 발현 효모에서 WSE-7423 EzBactYeastCrusher를 사용하여 추출한 단백질을 V5 항체를 사용하여 면역 침강한 결과를 나타냅니다. 아래 사진은 추출 후 단백질을 Blue LED하에서 EGFP의 형광을 검출한 이미지입니다. 전기영동 패턴의 레인A는 발현 유도하지 않았기 때문에 EGFP 밴드는 검출되지 않았습니다. 그러나 발현 유도한 레인 B와 C에는 명료하게 EGFP 밴드가 검출되었습니다. 레인 B는 환원제인 DTT를 첨가한 상태에서 단백질을 추출하였기 때문에 면역침강에서 사용한 항체유래 밴드도 환원되어 Heavy chain(75kDa)과 Light chain(25kDa)으로 나뉩니다. 한편 레인 A와 C는 환원제를 첨가하지 않고 추출하여 항체가 환원되지 않고 150kDa 밴드로 검출되었습니다. 이와 같이 WSE-7423 EzBactYeastCrusher를 사용하여 추출한 단백질은 단백질의 변성이 최소한으로 억제되어 있어 Antigen site-Antibody complex가 손상되지 않고 활성을 유지한 상태(EGFP의 형광)임을 알 수 있습니다.
4. 동물세포의 단백질 추출 방법
비교적 부드러운 조직의 경우 Potter형 Homogenizer가, 또한 대량의 조직을 다루는 경우 Waring Blender나 Blender가 이용되고 있습니다. 물론 미생물과 마찬가지로 초음파 파쇄나 동결 융해법에 의한 파쇄도 이용됩니다. 또 동물 세포에는 세포벽이 없기 때문에, 삼투압에 의해 세포막을 파괴해 소기관 등을 분획하는 방법이 있습니다. 어떤 종류의 효소 추출에는 유기용매(아세톤)에 의한 추출법이 이용됩니다. 그 외 효소나 계면활성제를 이용한 추출방법도 일반적으로 자주 이용됩니다. ATTO의 WSE-7420 EzRIPA Lysis kit는 Protease Inhibitor와 Phosphatase Inhibitor가 포함되어 있어 세포에 섞는 것만으로 단백질을 안정적으로 추출할 수 있습니다.
4-1. 실험방법
실험재료
배양세포 (10 cm dish, 5~20×10⁶ cells)
WSE-7420 EzRIPA Lysis kit
WSE-7430 EzPBS
마이크로 원심튜브, 피펫 tip 등
원심기, 마이크로피펫 등
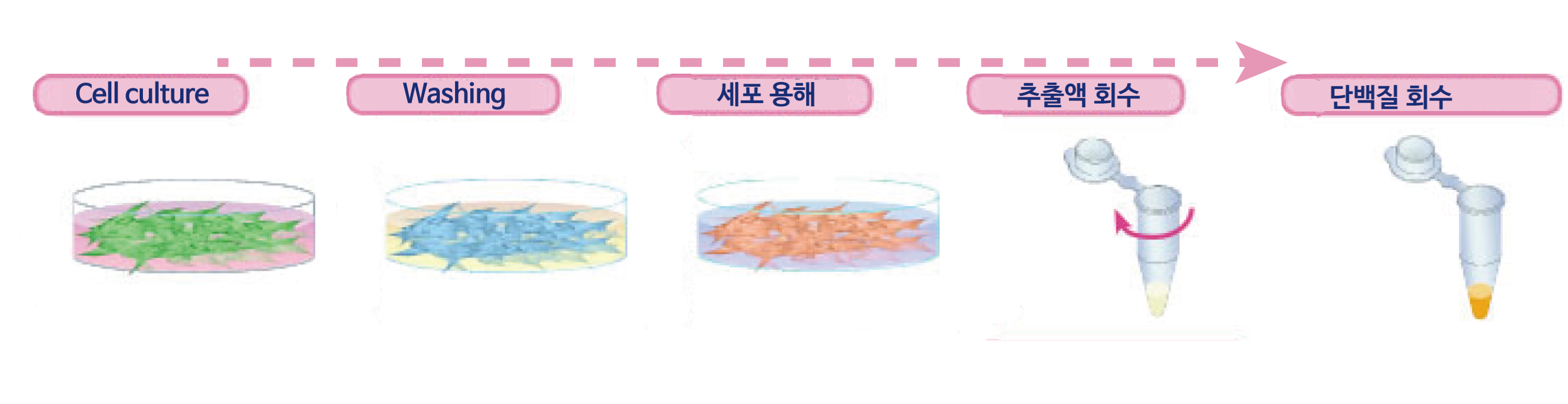
Cell culture
세포를 적당한 배지에서 Confluent할때까지 배양합니다. (5~20×10⁶ cells 상당)
* 사용하는 세포에 따라 세포의 크기나 밀도에 따라 회수되는 세포 수는 다릅니다.
Washing
WSE-7430 EzPBS로 2회 세척합니다.
* WSE-7430 EzPBS는 사용전에 증류수로 10배 희석합니다.
* Adherent cell은 떼어내지 않고 Washing합니다. Suspension cell은 Microcentrifuge tube에 집균하여 WSE-7430 EzPBS에 현탁하여 Washing합니다.
* 세정 후 세포는 -80℃에 보관 가능합니다.
세포 용해
1.0 mL의 RIPA Lysis buffer를 첨가하여 ice에 15분간 정치합니다.
* RIPA Lysis buffer에는 미리 WSE-7420 EzRIPA Lysis kit에 포함된 Protease Inhibitor와 Phosphatase Inhibitor를 첨가합니다.
* Suspension cell은 원심분리 시 RIPA Lysis buffer (조정 완료)를 첨가하여 Pipetting으로 풀어준 후, ice에 15분간 정치합니다.
추출액 회수
세포를 Scraper 등으로 긁어내어 Microcentrifuge tube에 회수합니다. 이 세포 추출액을 15,000×g
세포를 스크레이퍼 등으로 긁어내어 마이크로 원심 튜브로 회수합니다.이 세포 추출액을 4℃, 15,000xg에서 5~15분간 원심분리합니다.
* Suspension cell도 위와 마찬가지로 원심분리합니다.
단백질 회수
상등액을 새로운 Microcentrifuge tube로 모아줍니다. 가용화된 단백질 용액은 사용시까지 ice에서 보관 또는 -80℃에서 보관합니다.
* 핵단백질도 추출하는 경우는 SDS를 최종농도가 0.5%가 되도록 첨가하면 추출효율이 높아집니다. DNA 용출로 인해 점성이 높아지므로 초음파 파쇄 또는 DNase I를 처리합니다.
일반적인 동물세포 단백질 추출방법
동물조직·세포로부터 단백질을 추출하기 위해서는 세포를 파쇄해야 합니다. 일반적으로 샘플을 파괴하는 방법으로는 ① 물리적파쇄 (용매를 샘플의 3~10배 첨가하여 균질한다), ② 초음파파쇄(50 mg/mL 이하의 농도로 냉각하면서 1~10분간 초음파를 가한다), ③ 동결융해, ④ 가압파쇄 (French press 등), ⑤ 삼투압쇼크 (pH, 이온강도 변화), ⑥ 유기용매 (아세톤, 알코올에 의해 지질막 구조 파괴), ⑦ 효소처리 (세포벽의 효소 파괴 등), ⑧ 계면활성제 이용 등을 들 수 있습니다.
5. 세포소기관의 단백질 추출 방법
세포 내의 단백질은 세포질과 핵, 미토콘드리아 등 어떤 특정 영역에 분포하는 단백질이 있습니다. 이 단백질은 자극이나 세포주기 등의 영향을 받아 위치나 기능이 변화하는 경우가 있습니다. 세포 전체에는 매우 많은 단백질이 존재하므로 Target protein의 identification이나 분리, 정제가 어려운 경우가 있습니다. 이런 경우 세포를 세포소기관별로 나누어 해석함으로써 단백질을 추출할 수 있어 Target protein의 동정이나 기능 해석을 보다 간단하게 할 수 있게 됩니다.아토의 WSE-7421 EzSubcell Extract는 Protease Inhibitor와 DNase I이 포함되어 있어 세포에 섞는 것만으로 세포질 분획, 핵분획, 미토콘드리아등의 막분획, 불용성 분획 각각을 분리·추출 가능합니다.
5-1. 실험방법
실험재료
배양세포 (10 cm dish, 5~20×10⁶ cells)
WSE-7421 EzSubcell Extract
WSE-7430 EzPBS
마이크로 원심튜브, 피펫 tip 등
원심기, 마이크로피펫 등
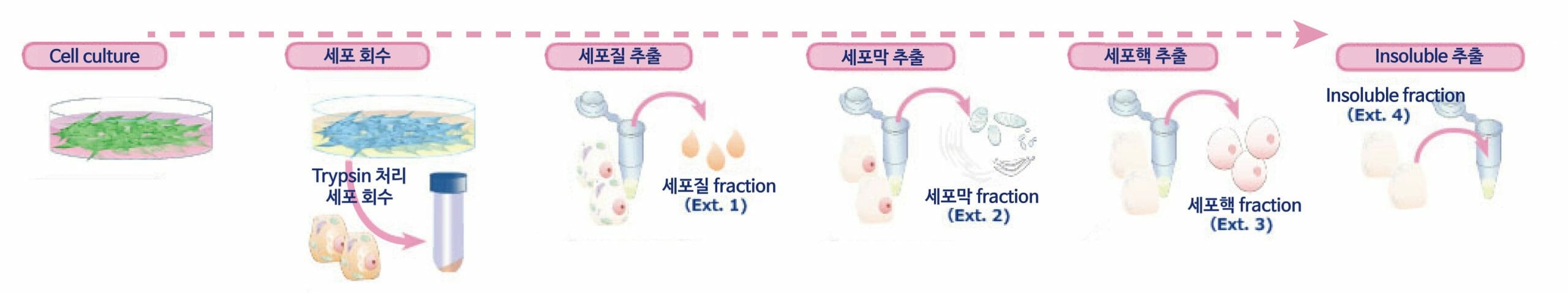
Cell culture
세포를 적당한 배지에서 Confluent할때까지 배양합니다. (5~20×10⁶ cells 상당)
* 사용하는 배지에 따라 세포의 크기나 밀도에 따라 회수되는 세포 수는 다릅니다.
세포 회수
세포를 WSE-7430 EzPBS로 Washing하고 Trypsin 등으로 Detach하여 회수합니다. 회수 후 세포는 다시 WSE-7430 EzPBS로 Washing합니다.
* 물리적 파괴를 피하기 위해 Scraper 등으로 떼어내지 않고 세포는 Dissociation하여 회수합니다.
* WSE-7430 EzPBS는 사용 전에 증류수로 10배 희석합니다.
* Suspension cell은 Microcentrifuge tube에 집균하여 WSE-7430 EzPBS에 현탁하여 Washing합니다. Washing 후 세포는 -80℃에서 보관 가능합니다. 동결 후 세포에서도 추출 가능합니다.
세포질 추출
세포에 ice에서 차갑게 한 1 mL의 Extraction buffer 1을 첨가한 후, vortex로 혼합하여 4℃에서 10분간 incubation합니다. 4℃, 700×g에서 5분간 원심분리하여 상등액을 Microcentrifuge tube에 회수합니다. (세포질 분획)
세포막 추출
Pellet에 ice에서 차갑게 한 1 mL의 Extraction buffer 2를 첨가한 후, vortex로 혼합하여 4℃에서 30분간 incubation합니다. 4℃, 4,000×g에서 5분간 원심분리하여 상등액을 Microcentrifuge tube에 회수합니다. (세포막 분획)
* 세포막 분획에는 미토콘드리아, 골지체, 소포체 등이 포함됩니다.
세포핵 추출
Pellet에 ice에 차갑게 한 0.5 mL의 Extraction buffer 3을 첨가한 후, vortex로 혼합하여 4℃에서 60분간 incubation합니다. 4℃, 9,000×g에서 5분간 원심분리하여 상등액을 Microcentrifuge tube에 회수합니다. (핵 분획)
Insoluble 추출
Pellet에 상온의 0.5 mL의 Extraction buffer 4를 첨가하여 vortex하여 용해합니다.
5-2. 참고 데이터
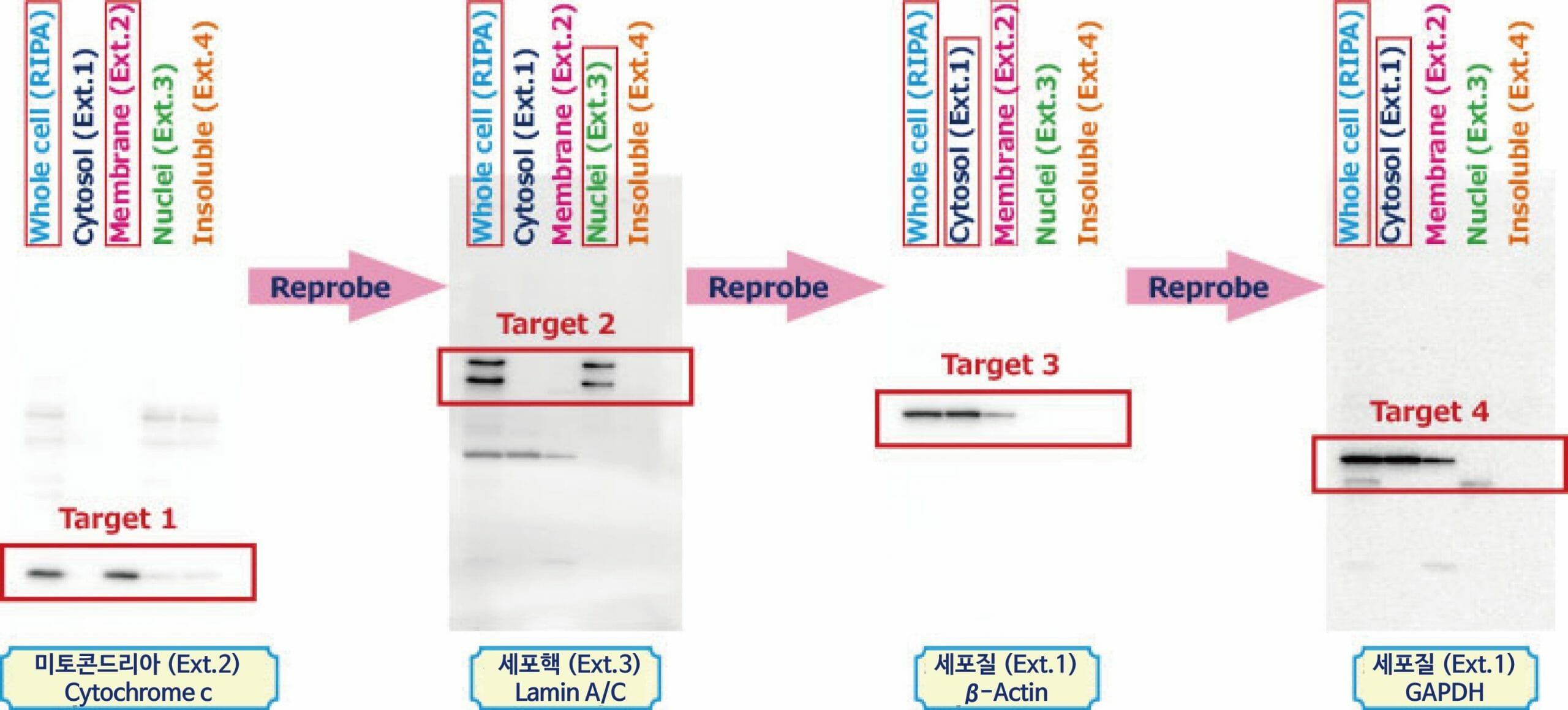
인간 결장암 유래 세포 SW480(2×10⁷ cells)를 WSE-7420 EzRIPA Lysis kit 및 WSE-7421 EzSubcell Extract를 사용하여 전 세포 (Whole cell), 세포질 분획(Cytosol, Ext.1), 세포막 분획(Membrane, Ext.2), 세포핵 분획(Nuclei, Ext.3), Insoluble 분획(Insoluble, Ext.4)의 단백질을 추출하여 AE-1430 EzApply를 이용하여 전기영동 샘플을 준비하였습니다. e-PAGEL (5-20% Gradient gel)로 분리하고 AE-1465 EzFastBlot을 사용하여 ClearBlot P plus Membrane에 전사하여 AE-1477 EzBlock CAS로 30분간 Blocking하였습니다. Blocking 후 Membrane을 Mitochondria 마커의 Cytochrome C항체, 이어서 HRP표지 2차항체와 반응하여 WSE-7120 EzWestLumi plus에서 검출하였습니다. (그림의 첫번째 이미지) Whole cell 추출액과 세포막 분획에서만 밴드가 검출되어, Mitochondria를 포함한 세포막 분획이 다른 소기관의 오염없이 분리된 것이 나타났습니다.
이 Membrane을 WSE-7240 EzReprobe로 항체를 Stripping한 후, 다시 AE-1477 EzBlock CAS로 Blocking 후, 세포핵 마커의 Lamin A/C 항체, 이어서 HRP표지 2차항체와 반응하여 WSE-7120 EzWestLumi plus로 검출하였습니다. (그림의 두번째 이미지) Whole cell과 세포핵 분획에서만 밴드가 검출되어 세포핵 분획 또한 다른 소기관의 오염없이 분리된 것을 알 수 있습니다.
다시 동일하게 Stripping, Blocking을 한 후, β-Actin항체와 반응하여 검출하였습니다. (그림의 세번째 이미지) 이 Membrane을 Stripping, Blocking한 후, GAPDH항체와 반응하여 검출하였습니다. (그림의 네번째 이미지)
세포질 마커인 β-Actin과 GAPDH는 Whole cell추출액과 세포질 분획에 밴드가 검출되었지만, 세포막 분획에도 검출되고 있어서 세포질 분획이 막 분획에 약간 혼재하고 있는 것이 나타났습니다. 이러한 경우, WSE-7421 EzSubcell Extract에 의한 소기관 분획의 추출법은 추출시마다 Washing조작을 실시하여 오염을 줄이고 소기관 분획을 추출하는 것이 가능합니다. 이와 같이 WSE-7421 EzSubcell Extract는 각 소기관 분획을 세포와 섞는 것만으로도 추출이 가능하여 WSE-7240 EzReprobe와 함께 사용하면 적은 양의 샘플로 많은 단백질의 발현을 알 수 있습니다.
실험예6: 추출액의 단백질량과 핵 염색 이미지
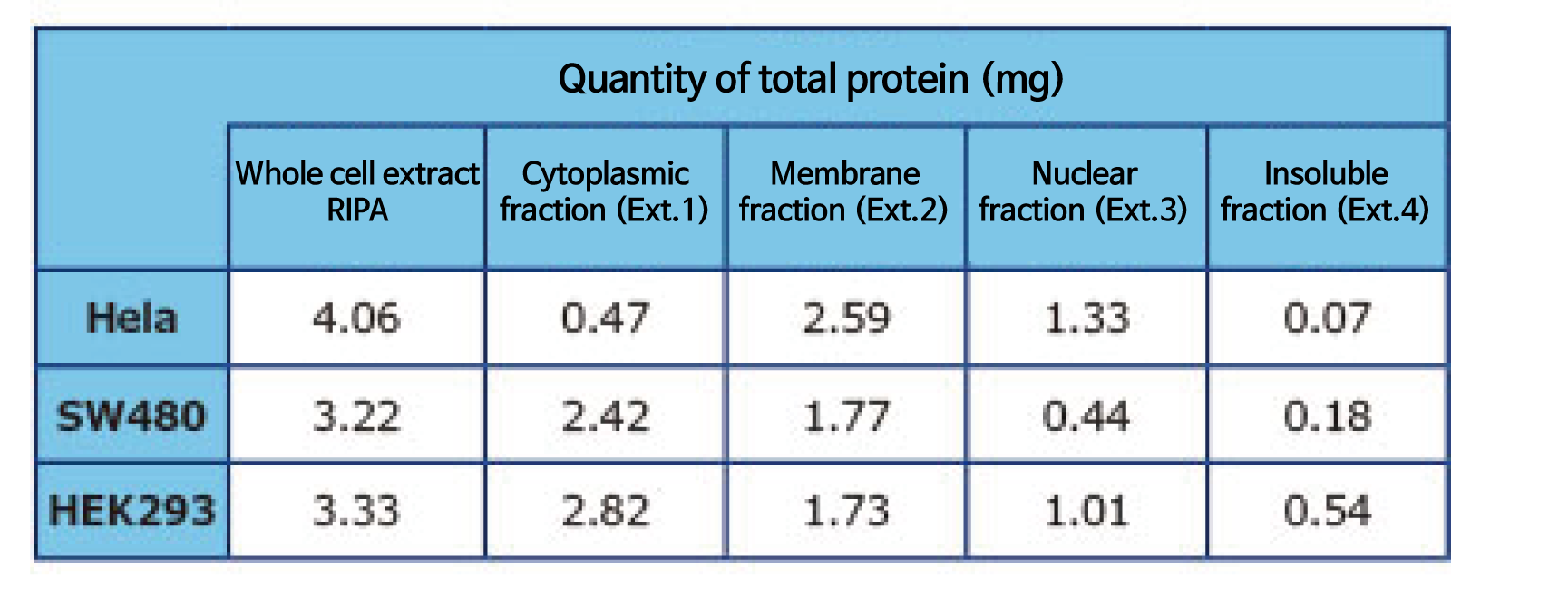
Confluent된 1개의 culture dish (φ100 mm, 1~2×10⁷cells)를 WSE-7421 EzSubcell Extract로 각 세포의 소기관 추출액을 조제하였습니다. Whole cell의 추출액은 WSE-7420 EzRIPA Lysis kit로 조제하였습니다. 단백질 농도는 BCA법을 이용하였습니다.
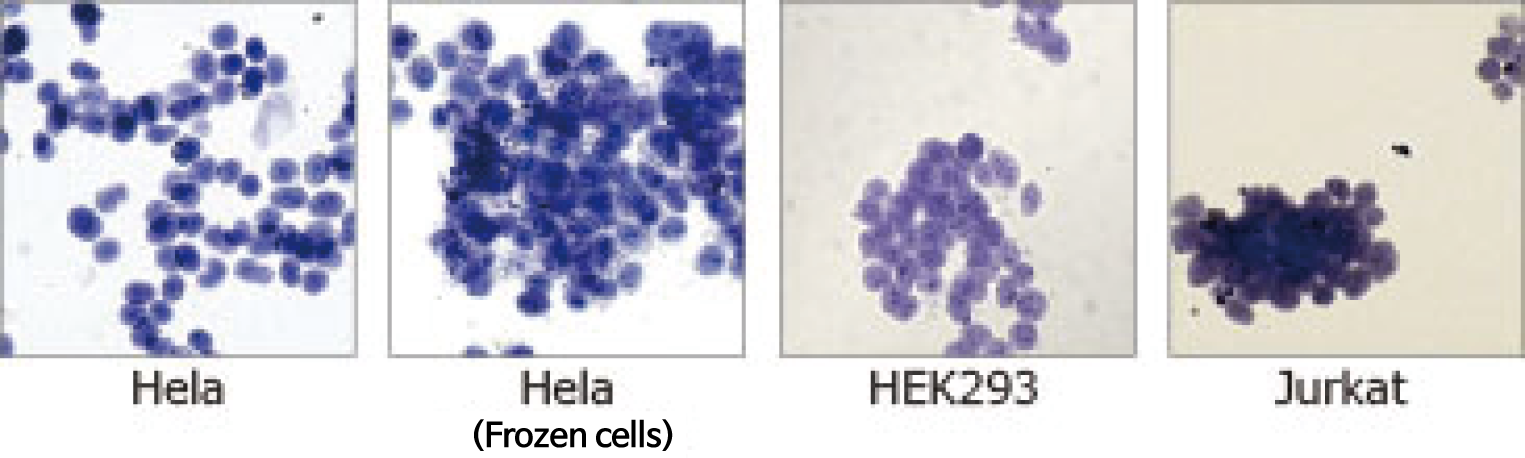
WSE-7421 EzSubcell Extract의 Extraction buffer 2를 처리한 후 Pellet을 Trypan blue로 염색하여 관찰한 것입니다. 핵 형상에 이상이 없이, 핵말이 유지된 상태로 분리된 것을 알 수 있습니다. 동결보존한 세포에서도 마찬가지로 핵 및 각 소기관의 추출액을 분리할 수 있습니다.
Related Products
대장균, 효모 단백질 추출 Kit
WSE-7423 EzBactYeast Crusher
대장균 및 효모와 혼합하는 것만으로 쉽게 단백질을 추출할 수 있는 Buffer입니다. 추출한 단백질은 정제, Immunoprecipitation, 효소활성 측정, Western blotting 등에 사용이 가능합니다.
키트 구성품: Yeast PreLysis buffer 100 mL, BactYeastLysis buffer 100 mL, DNase I 1 mL, Protease Inhibitor 1 mL
동물세포 단백질 추출 Kit
WSE-7420 EzRIPA Lysis kit
동물세포에서 단백질 추출에 가장 많이 사용되는 RIPA buffer입니다. 위와 동일하게 다양한 용도로 사용이 가능합니다.
키트 구성품: EzRIPA Lysis buffer 100 mL, Protease Inhibitor 1 mL, Phoshatase Inhihditor 1 mL
동물세포 단백질 추출 Kit (세포 소기관 분리용)
WSE-7421 EzSubcell Extract
동물세포와 혼합하는 것만으로 각 소기관의 단백질 (세포질, 막, 핵, Insoluble)을 분리, 추출할 수 있는 Kit입니다. 추출한 단백질은 상기와 동일하게 다양한 용도로 사용이 가능합니다.
키트 구성품: Extraction buffer 50/25 mL (4종), DNase 0.25 mL, Protease Inhibitor 1.25 mL
동물세포 단백질 추출 Kit (핵, 미토콘드리아, 세포질 분획용)
WSE-7422 EzSubcell Fraction
동물세포와 혼합하는 것만으로 핵, 미토콘드리아, 세포질로 분획할 수 있는 Kit입니다. 추출한 단백질은 위와 동일하게 다양한 용도로 사용이 가능합니다.
키트 구성품: Fraction buffer 50 mL (2종), RIPA Lysis buffer 20 mL, Detergent mix 1 mL, Protease Inhibitor 0.7 mL
Phosphate buffer
WSE-7430 EzPBS
세포 준비시에 사용하는 일반적인 PBS Buffer의 10배 농축용액입니다.
Tips for Western Blotting
- Basic operation of Western blotting
- Method for extracting protein from tissue or cell
- Principle and workflow of Semi-dry blotting
- Western blotting (Transfer)
- How to choose the reagents for semi-dry blotting
- Transfer method according to transfer buffer and consumables
- Western blotting (Blocking)
- Western blotting (Antibody reaction and detection)
- Normalization (Western blotting data)
